《医疗器械注册与备案管理办法》最全解读,这些变化你一定要知道!
2021-09-28
8月31日,国家市场监督管理总局审议通过了《医疗器械注册与备案管理办法》和《体外诊断试剂注册与备案管理办法》(以下简称两个《办法》),自2021年10月1日起施行。
9月2日,国家药监局器械注册司注册一处二级调研员胡雪燕通过在线形式对《医疗器械注册于备案管理办法》进行了全方位的解读。
她表示,改革永远在路上,不断的改革也给监督管理带来全新的挑战,但也希望通过不断的修订能为企业提供更合理、高效的政策支持。
胡调研员表示,两个《办法》落实“四个最严”要求、细化监管制度,鼓励创新发展、强化主体责任,落实“放管服”改革要求,完善监管要求、提高监管科学性,充实监管手段、提高监管效率,优化科学高效的审评审批程序。
对比原《办法》,新的《办法》修订后原有部分文件条款后续将发生变化,例如后期待发布及拟废止的文件:
01 待发布文件
1)医疗器械注册申报资料要求和批准证明文件格式;
2)体外诊断试剂注册申报要求和批准证明文件格式;
3)体外诊断试剂分类规则;
4)关于实施《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》有关事项通知;
5)医疗器械注册自检工作规定;
6)医疗器械临床评价技术指导原则;
7)医疗器械等同性论证技术指导原则;
8)决策是否开展医疗器械临床试验技术指导原则;
9)医疗器械注册申报临床评价报告技术指导原则;
10)列入免于进行临床评价医疗器械目录产品对比说明技术指导原则。
02 拟废止文件
1)关于印发医疗器械注册复审程序(试行)的通知(食药监办械{2010}92号);
2)关于实施《医疗器械注册与备案管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械管{2014}144号);
3)关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管{2014}192号);
4)关于修改医疗器械延续注册等部分申报材料要求的公告(2018年第53号);
5)关于调整医疗器械临床试验审批程序的公告(2019年第26号);
6)关于公布新修订免于进行临床试验医疗器械目录的通告(2018年第94号);
7)关于公布新增和修订的免于进行临床试验医疗器械目录的通告(2019年第91号);
8)关于发布免于进行临床试验医疗器械目录(第二批修订)(2021年 第3号);
关于发布医疗器械注册指定检验工作管理规定的通告(2015年第94号)。

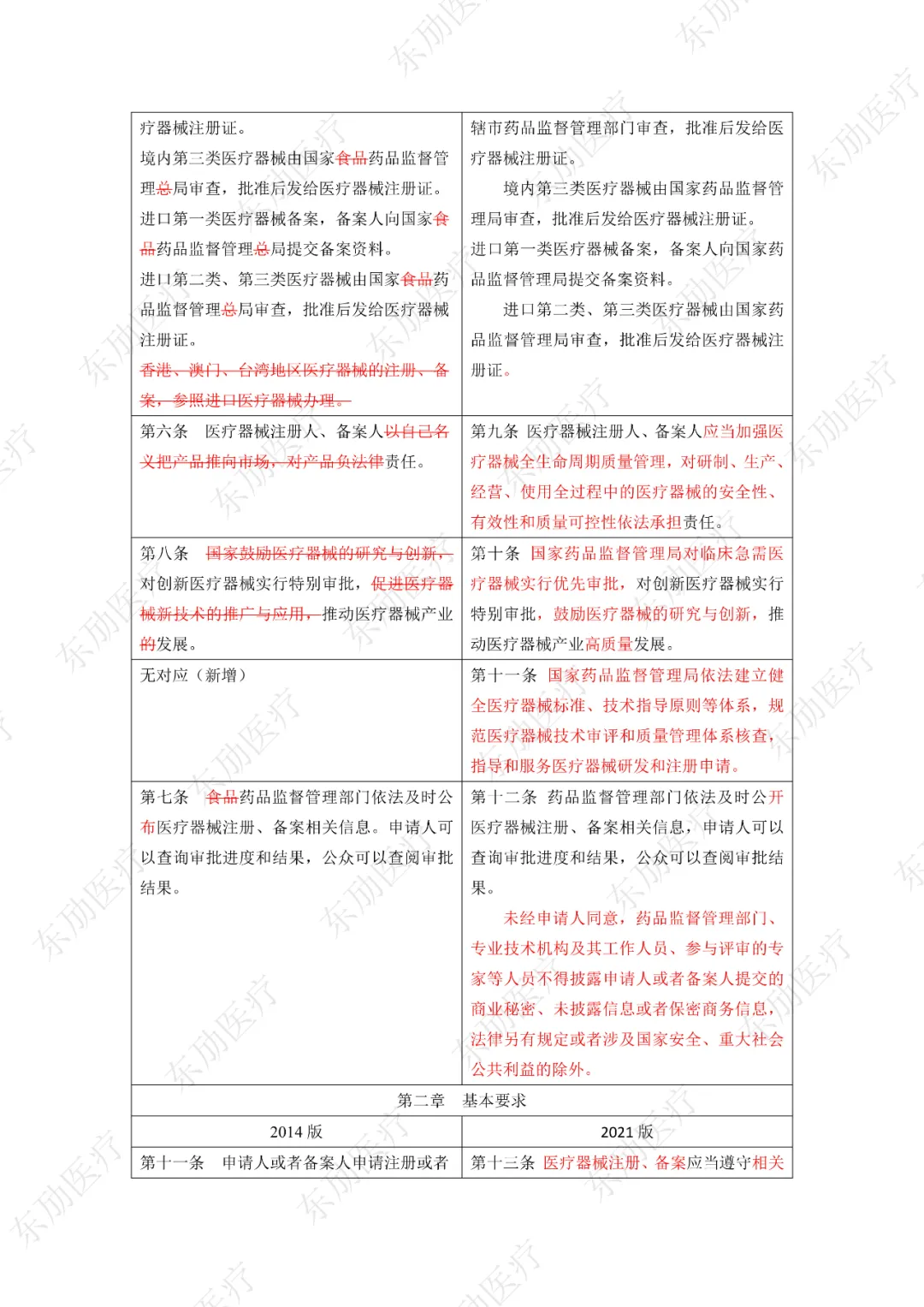
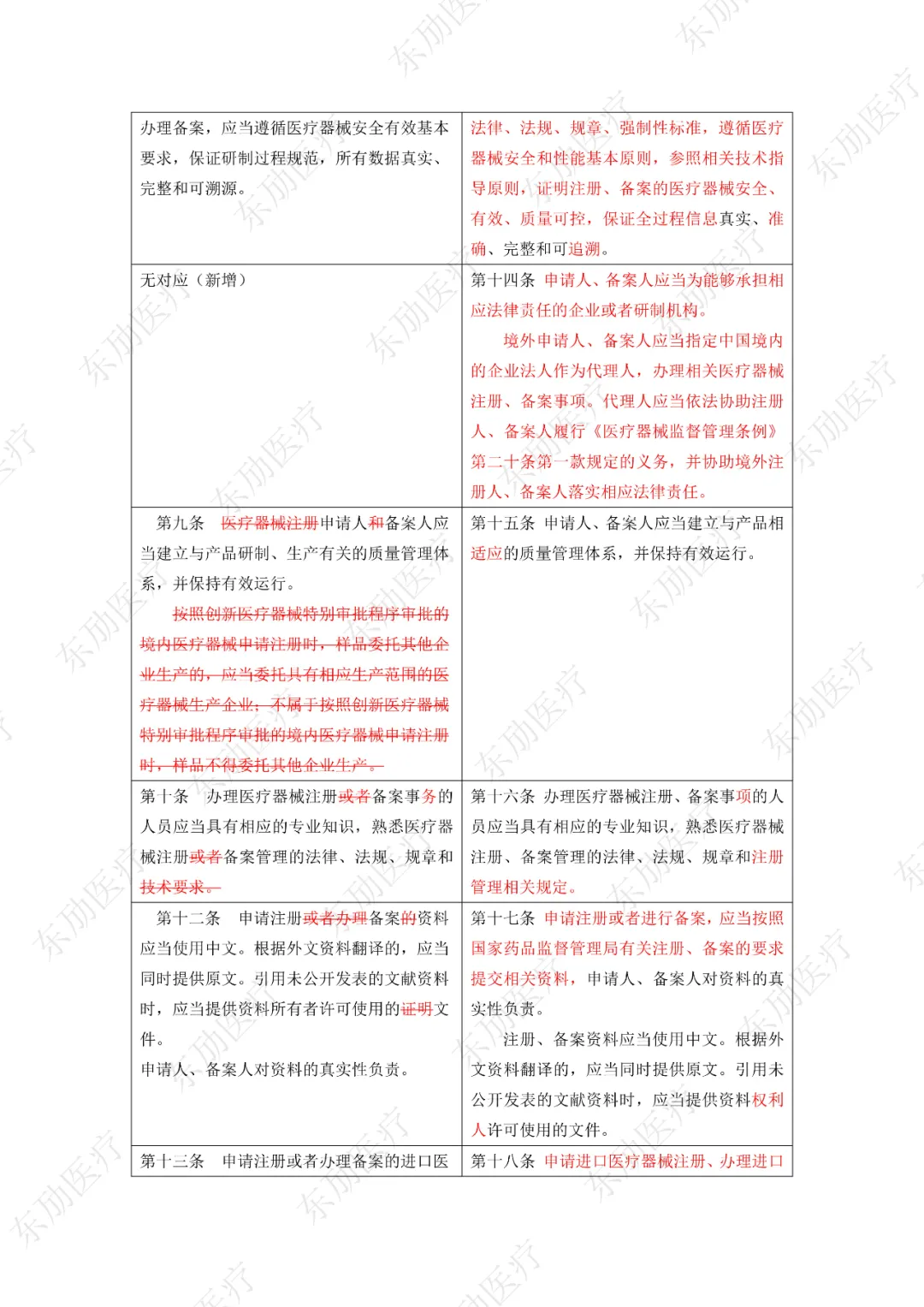
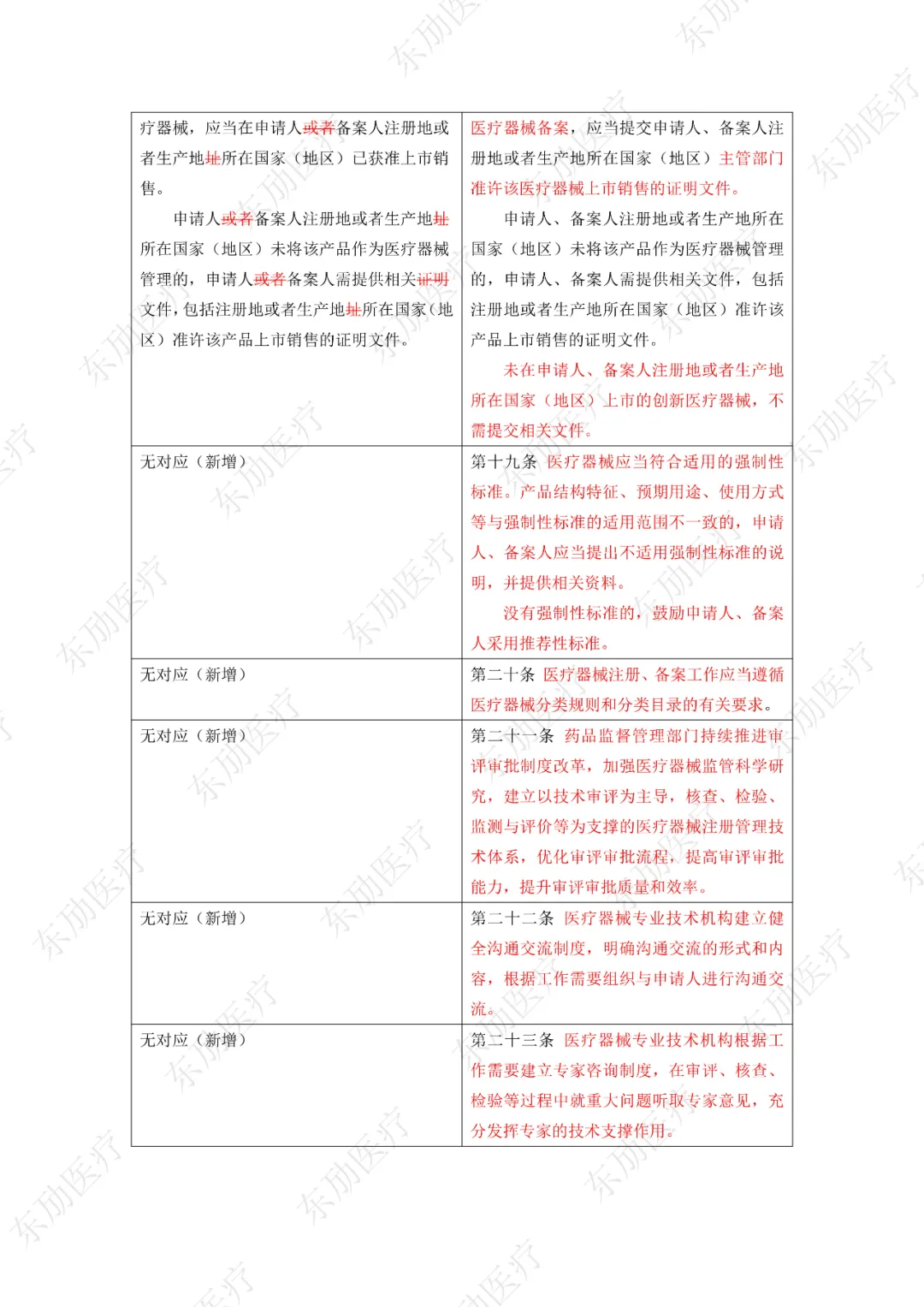
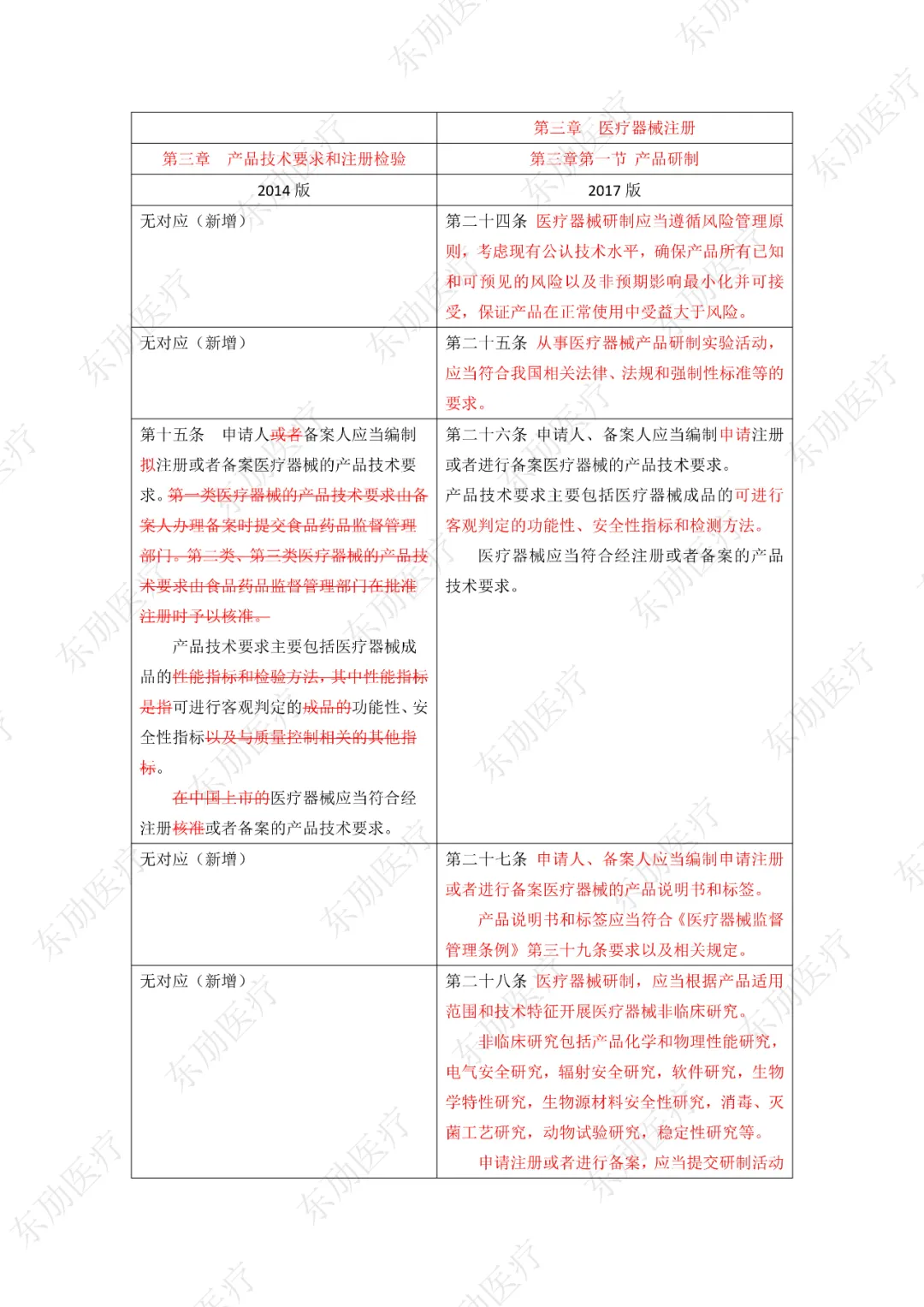
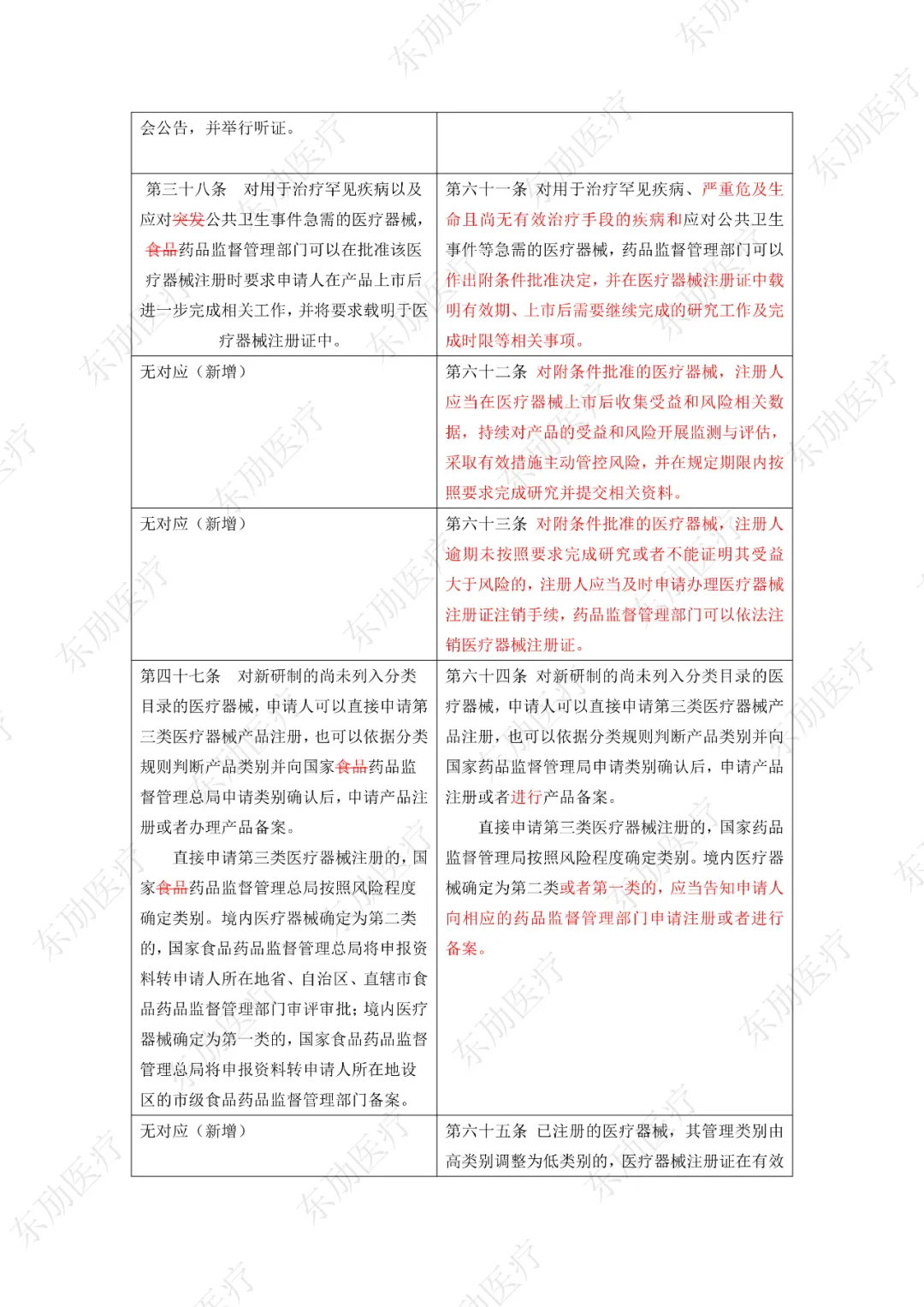
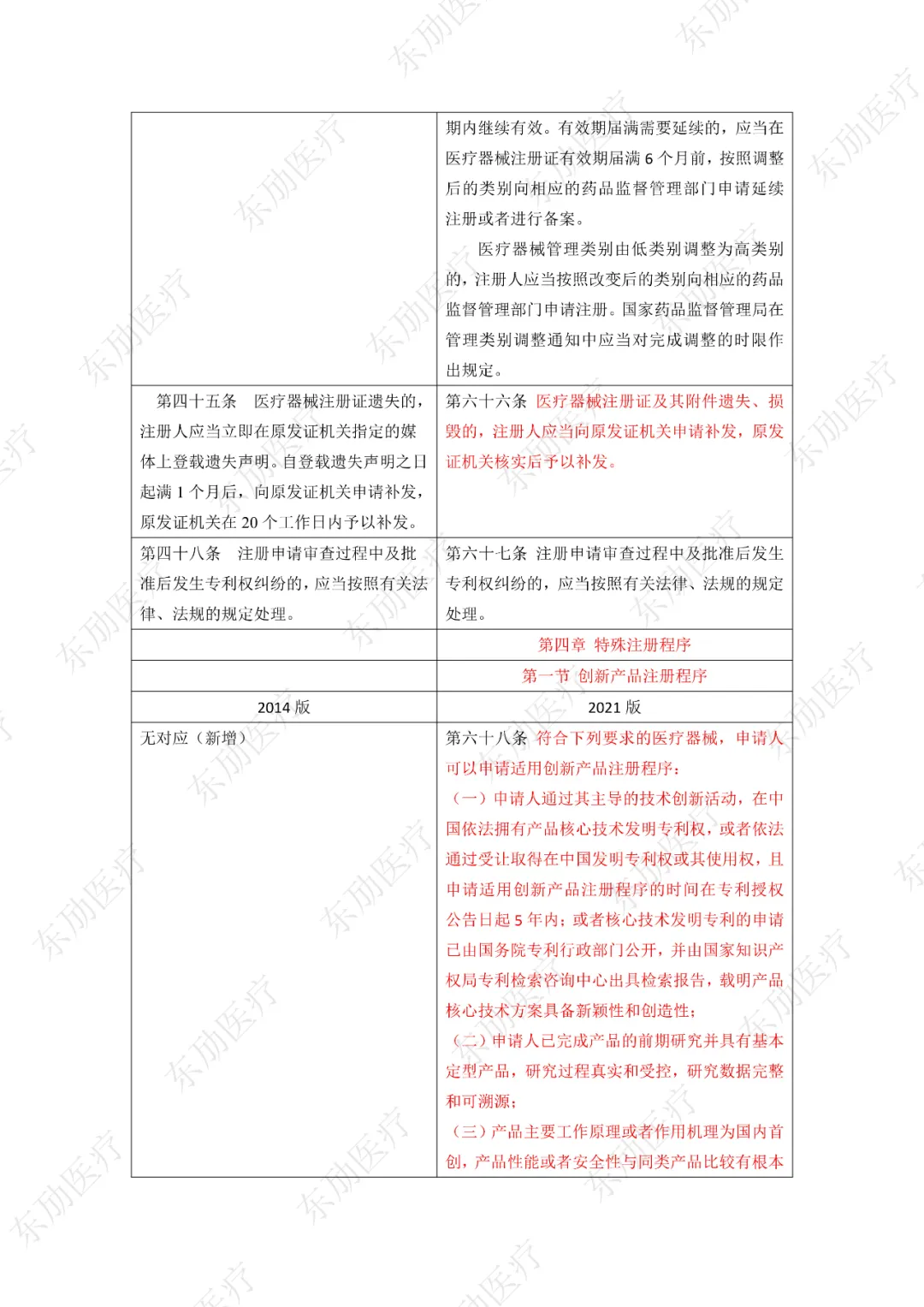
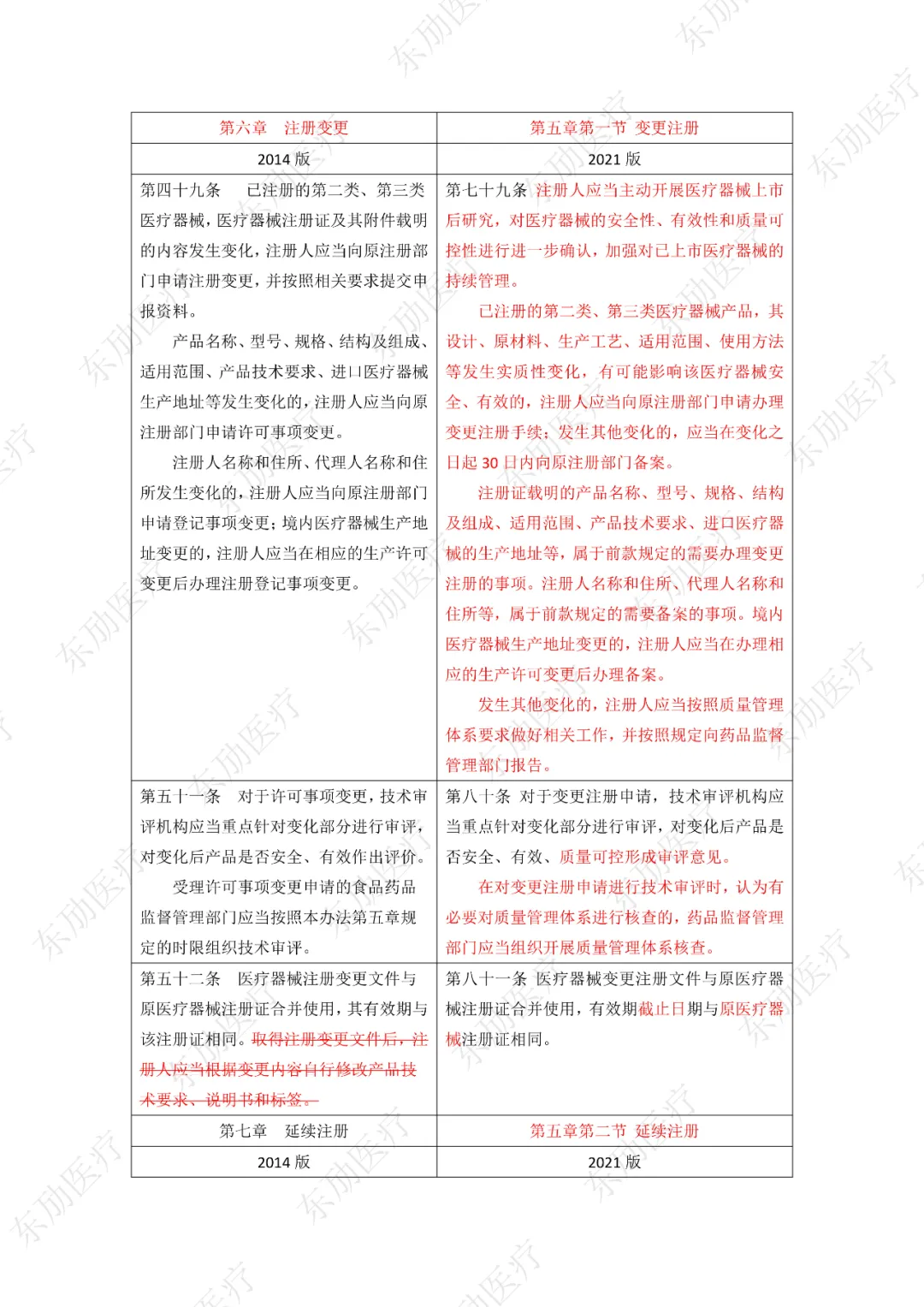
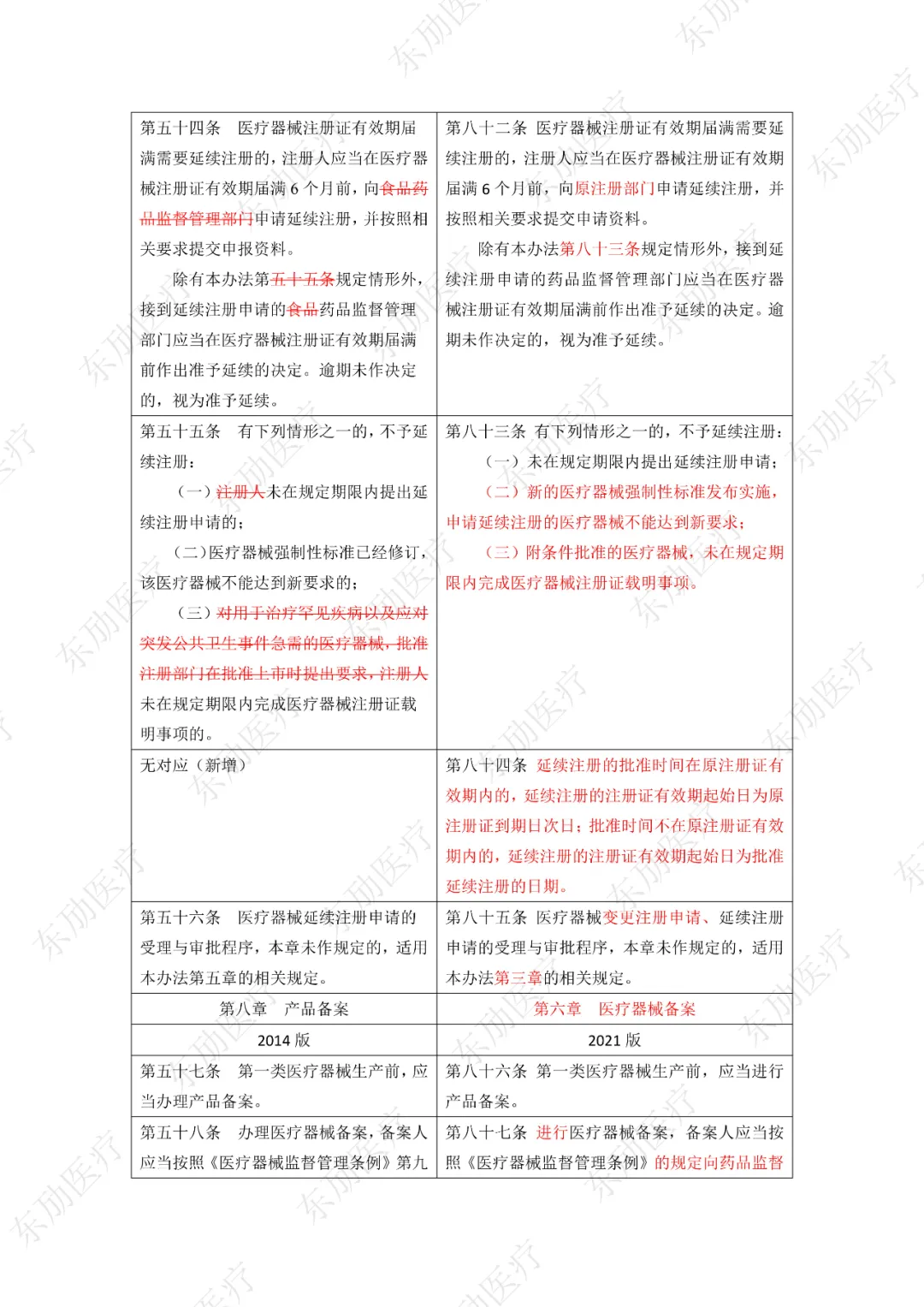
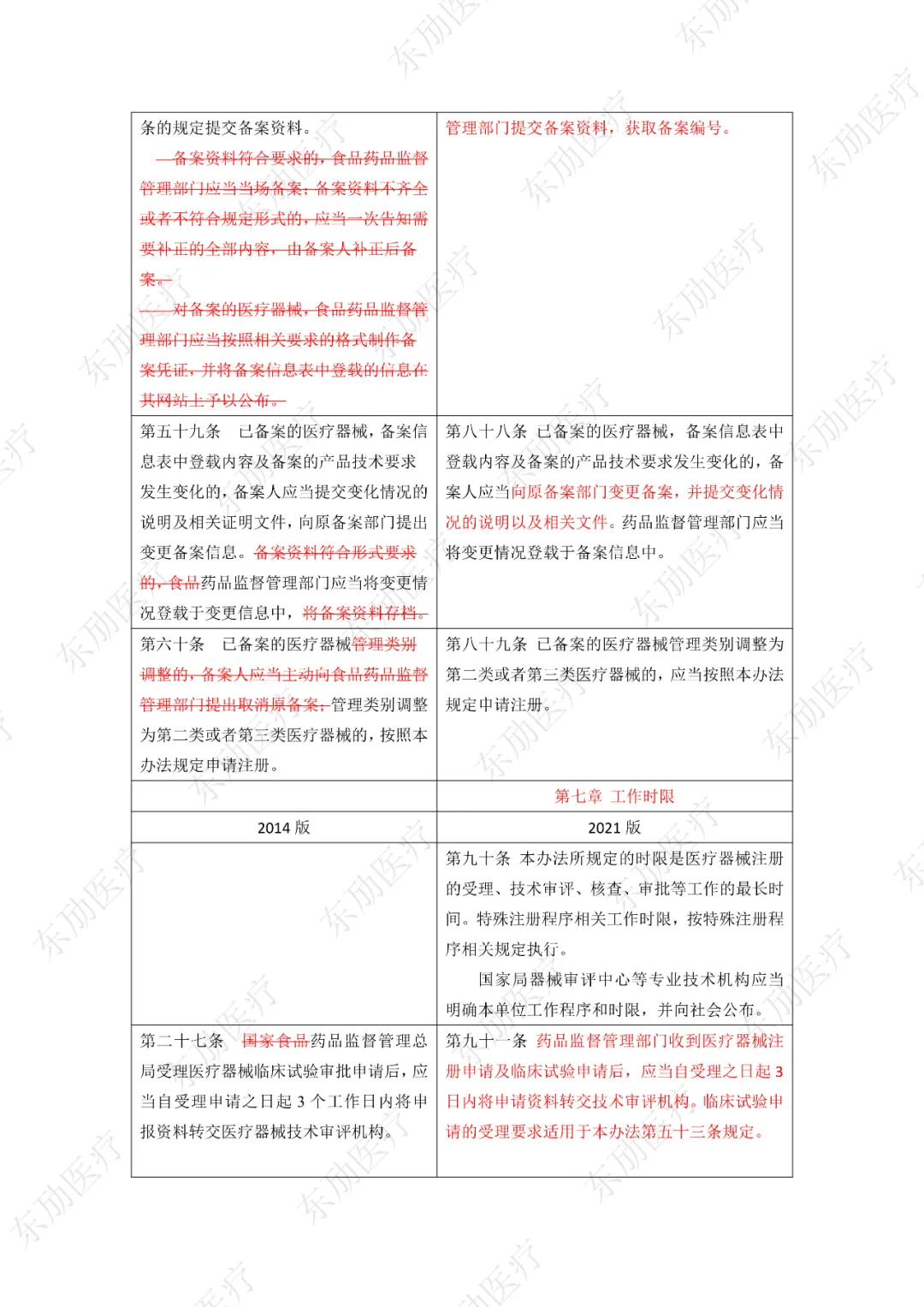
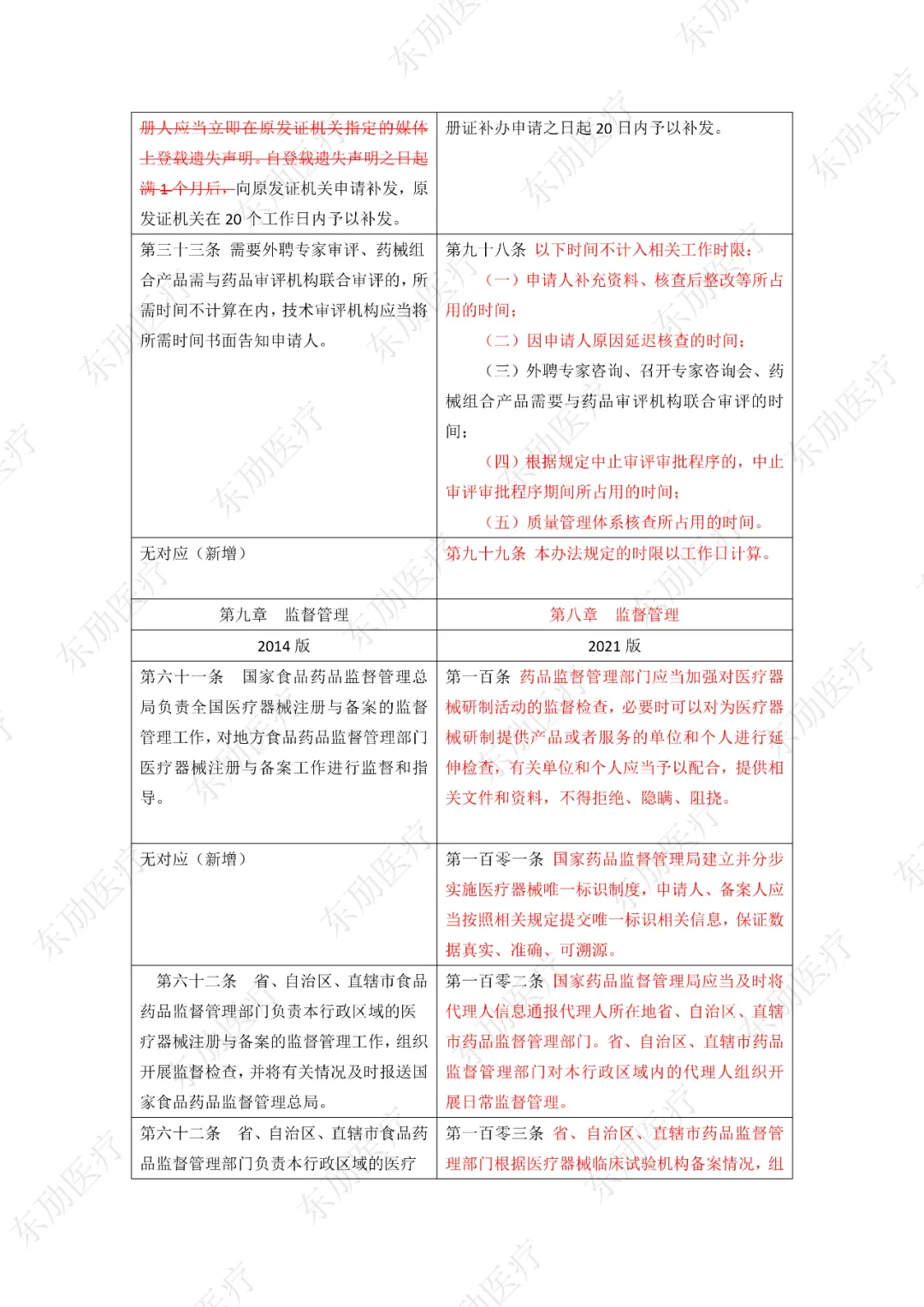
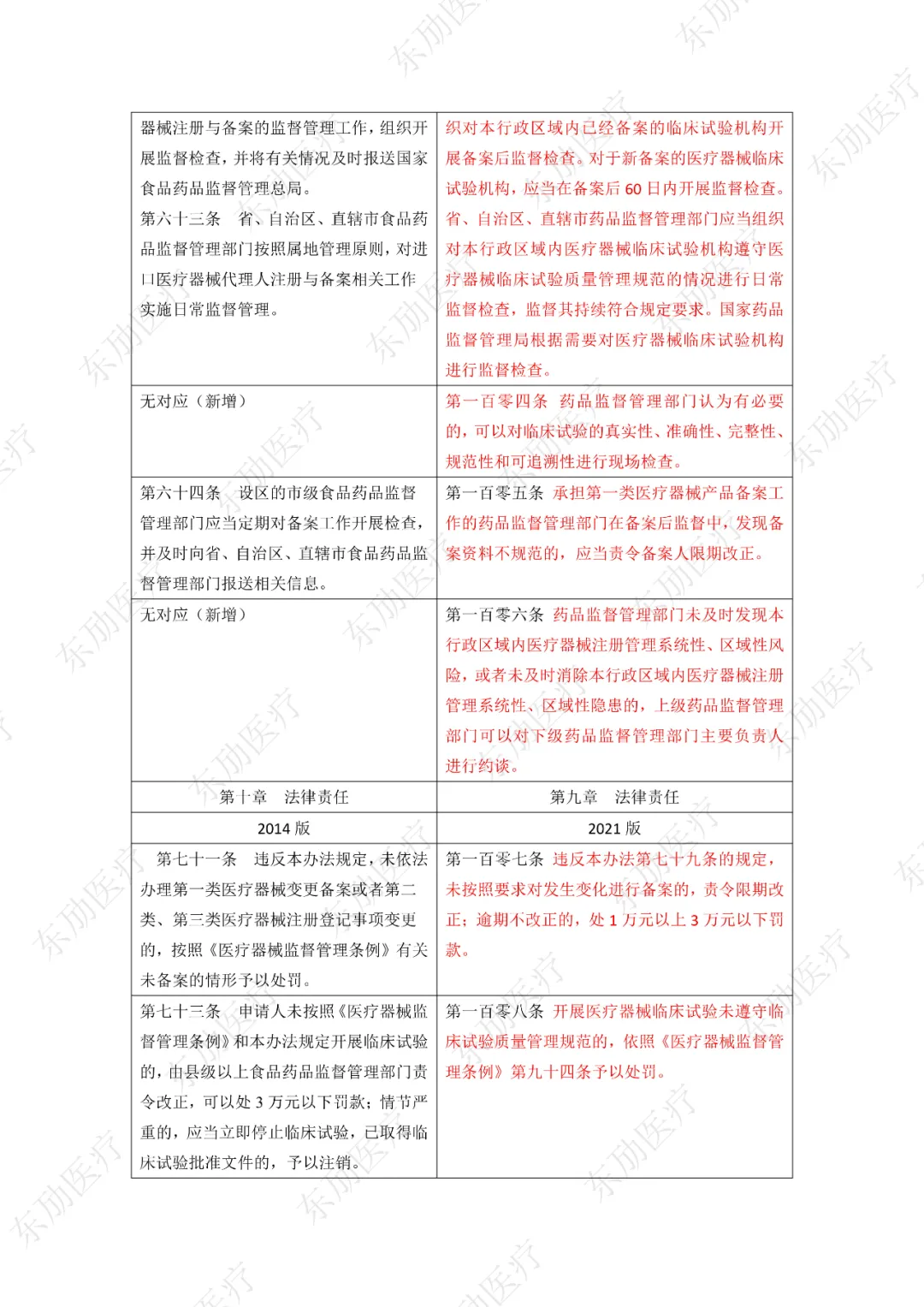
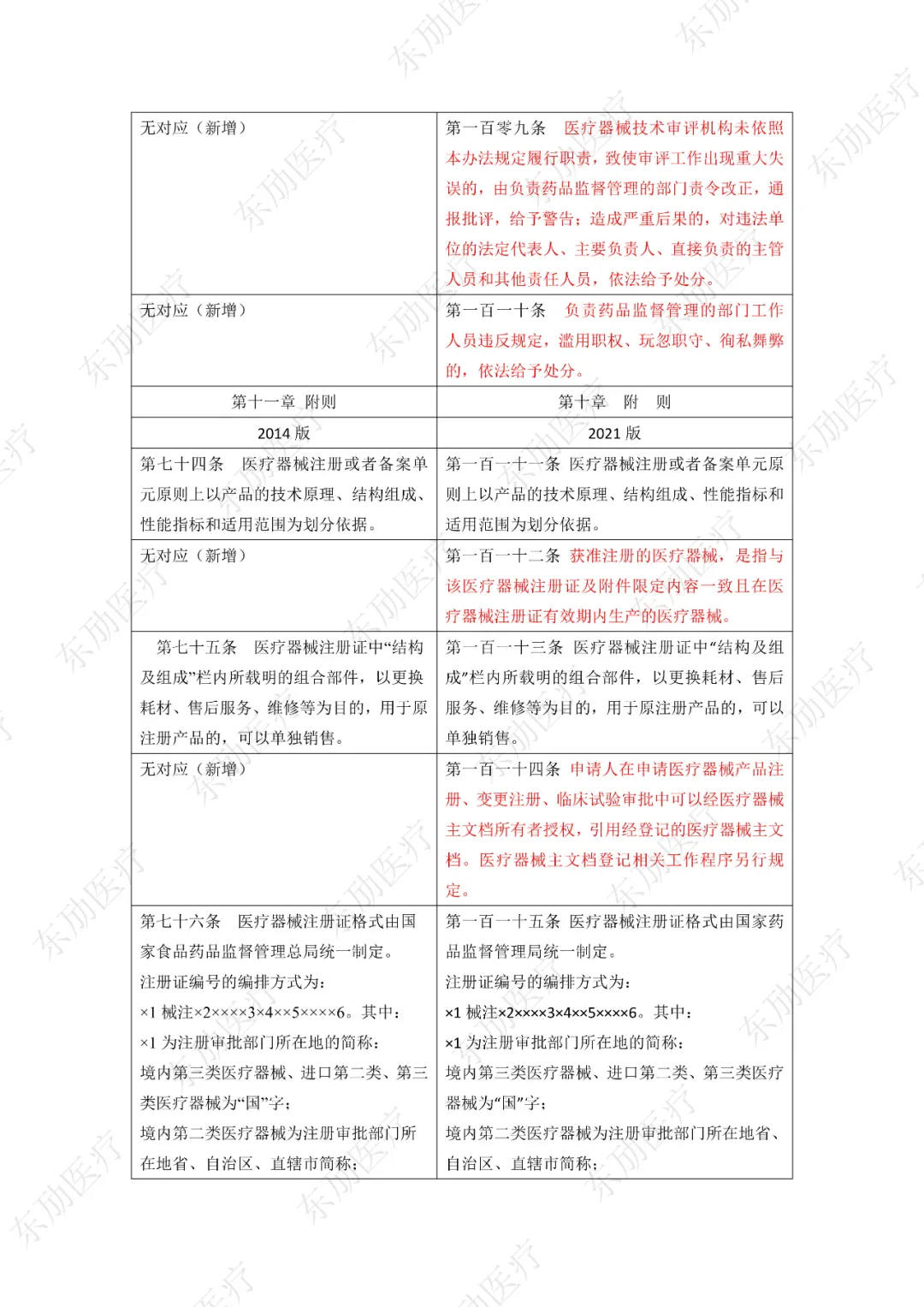
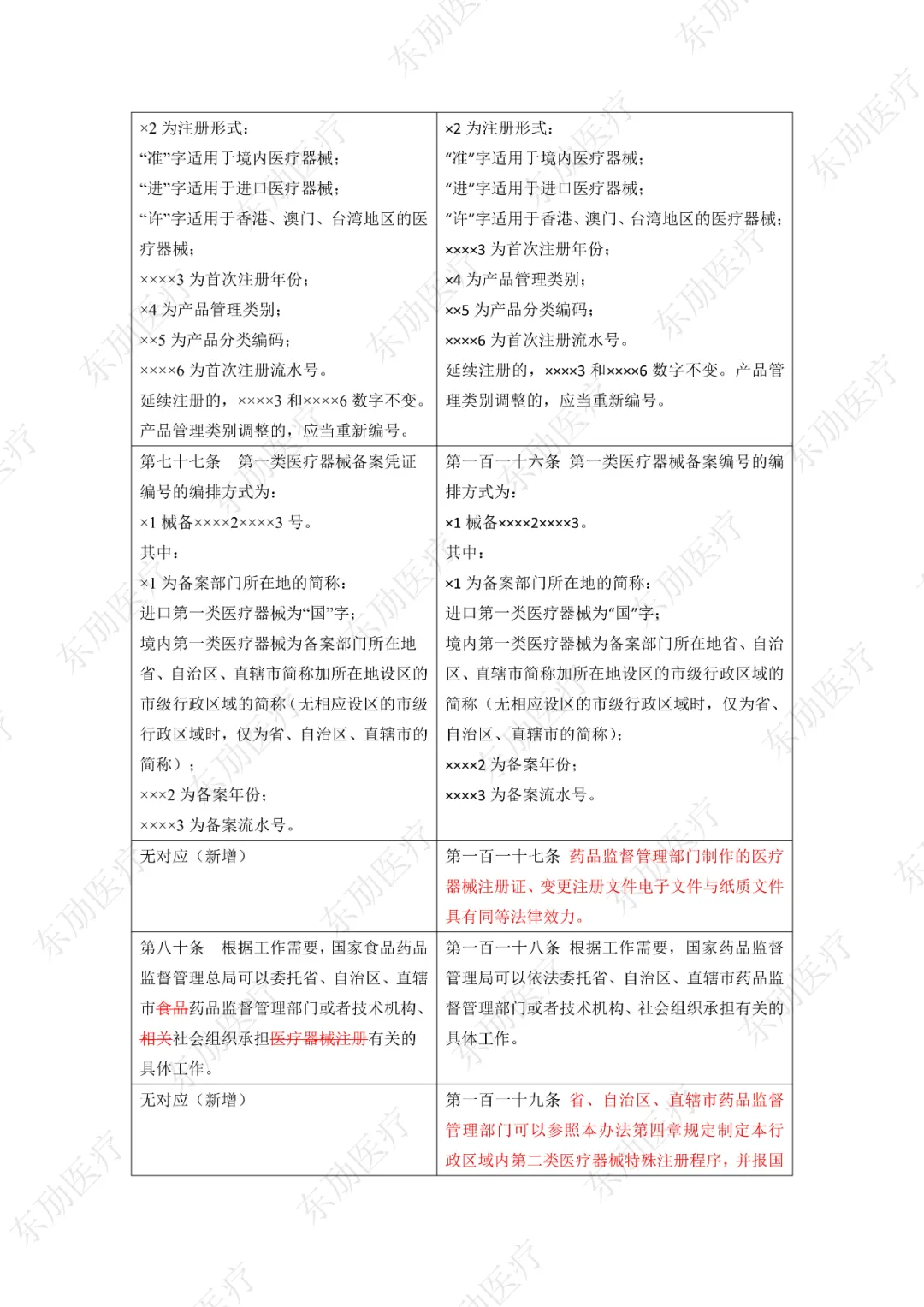
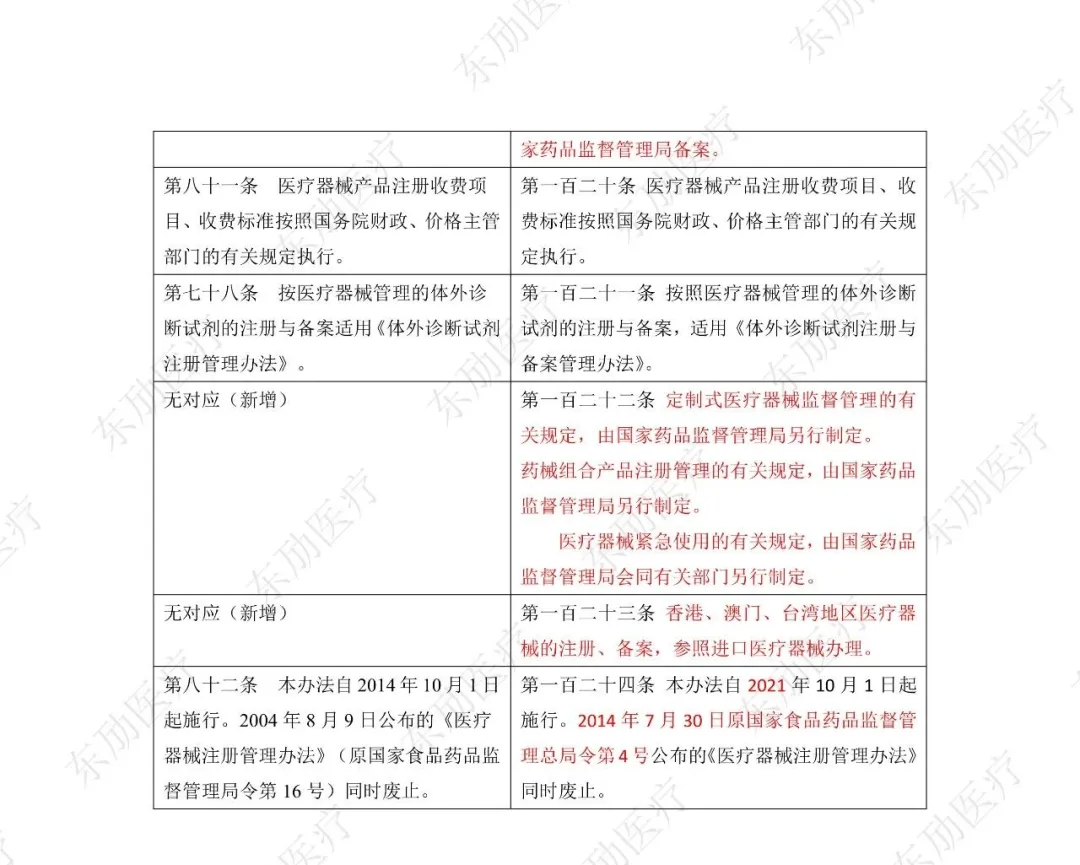
修订后的《医疗器械注册与备案管理办法》共10章124条,原《办法》共11章82条。对比原版增加了第四章特殊注册程序及第七章工作时限的相关规定。同时对原有的部分章节进行了合并。
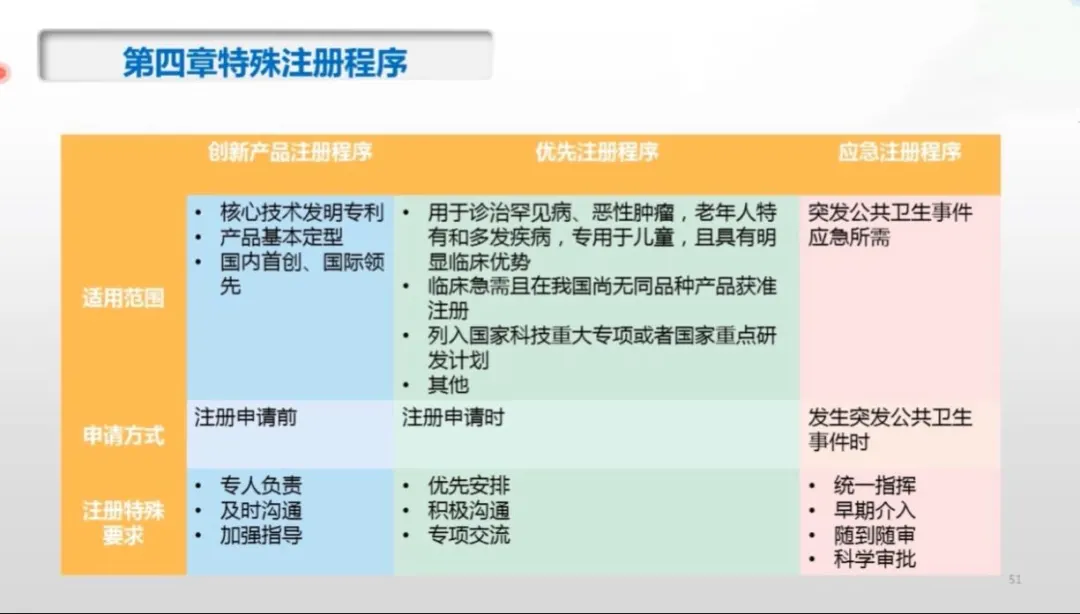
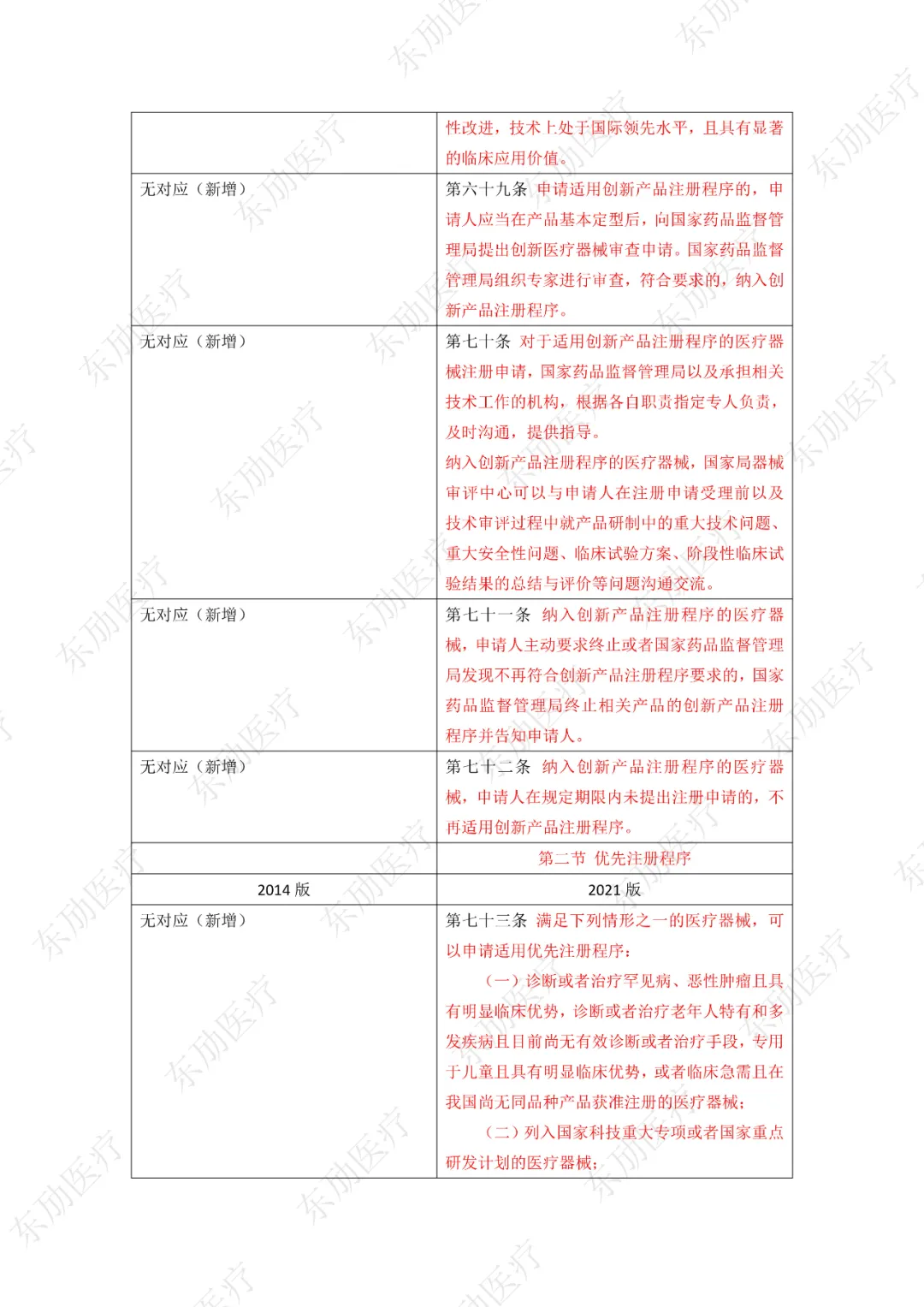
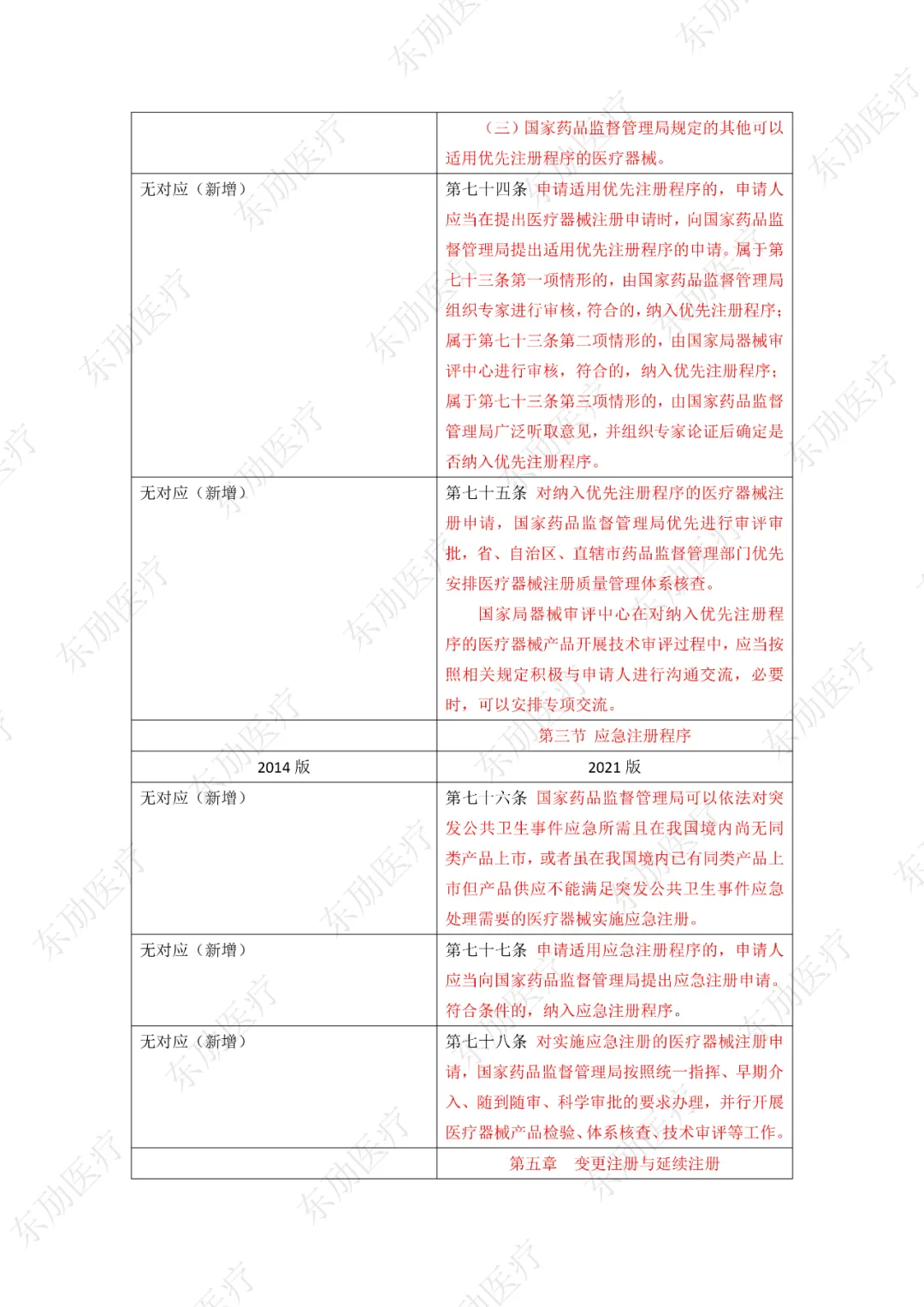
第四章特殊注册程序分三类:创新产品注册程序、优先注册程序、应急注册程序。以下为特殊注册三个阶段的适用范围、申请方式及注册特殊要求的区别点。
第七章 工作时限的规定:(单位:天)
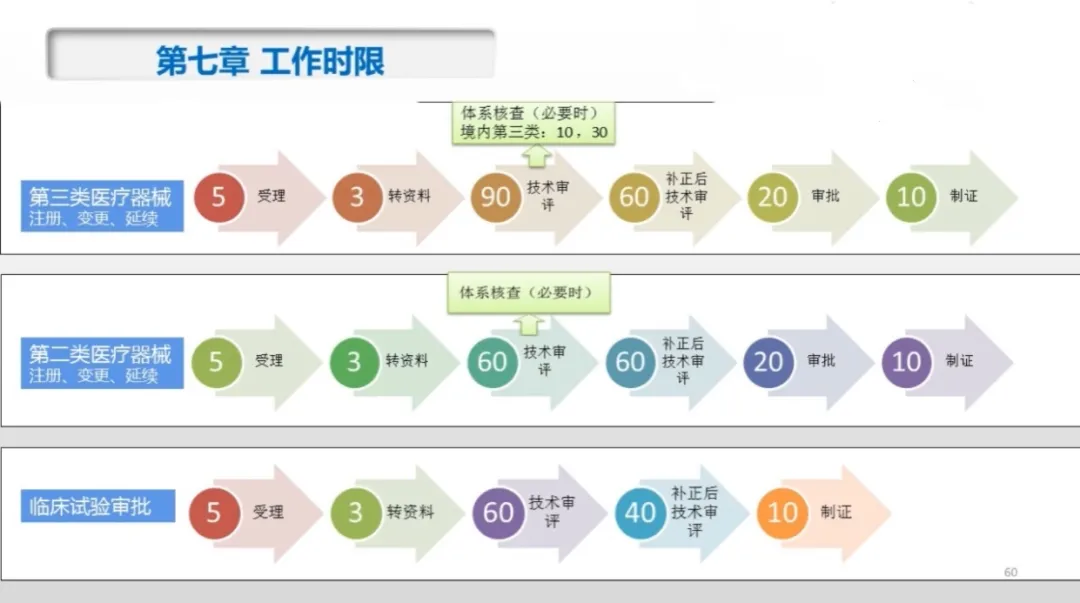
不计入相关工作时限的情形:
(一)申请人补充资料、核查后整改等所占用的时间;
(二)因申请人原因延迟核查的时间;
(三)外聘专家咨询、召开专家咨询会、药械组合产品需要与药品审评机构联合审评的时间;
(四)根据规定中止审评审批程序的,中止审评审批程序期间所占用的时间;
(五)质量管理体系核查所占用的时间。
时限延长的规定:
因产品特性以及技术审评、核查工作遇到特殊情况确需延长时限的,延长时限不得超过原时限的二分之一,经医疗器械技术审评、核查等相关技术机构负责人批准后,由延长时限的技术机构书面告知申请人,并通知其他相关技术机构。
《办法》的主要变化体现在以下细则当中:
1、落实注册人、备案人制度
2、明晰监管部门职责
3、增加特殊注册程序
4、优化审评审批工作程序
5、充实监管手段
6、明确产品研制要求
7、简化注册申报资料检验报告的要求
8、简化创新医疗器械原产国批件要求
9、科学设置临床评价要求
10、增加临床试验监管内容
11、明确附条件批准要求
12、调整延续注册的注册证起始时间
《医疗器械注册与备案管理办法》重点内容说明:
新修订《条例》中涉及医疗器械注册与备案管理的章节为:“第二章医疗器械产品注册与备案”
其中涉及医疗器械注册的条款为:第十三、十四、十六、十七、十八、十九、二十、二十一、二十二、二十三条,共10条;
涉及医疗器械备案的条款为:第十三、十四、十五、二十、二十三、二十四、二十五条,共7条;
涉及医疗器械临床评价/临床试验管理的条例为:第二十四、二十五、二十六、二十七、二十八、二十九条,共计6条;
与医疗器械注册、备案相关条款还有:第五条(管理原则)、第六条(分类管理)、第七条(标准)、第八条(鼓励创新)、第三十七条(通用名称)、第三十八条(唯一标识)、第三十九条(说明书、标签)、第六十六条(再评论)、第七十五条(检验机构资质);附则:定义、收费、相关部门、实施日期等。
修订后的《医疗器械注册与备案管理办法》共计分为:总则、基本要求、医疗器械注册、特殊注册程序、变更与延续、医疗器械备案、工作时限、监督管理、法律责任、附则等10章。
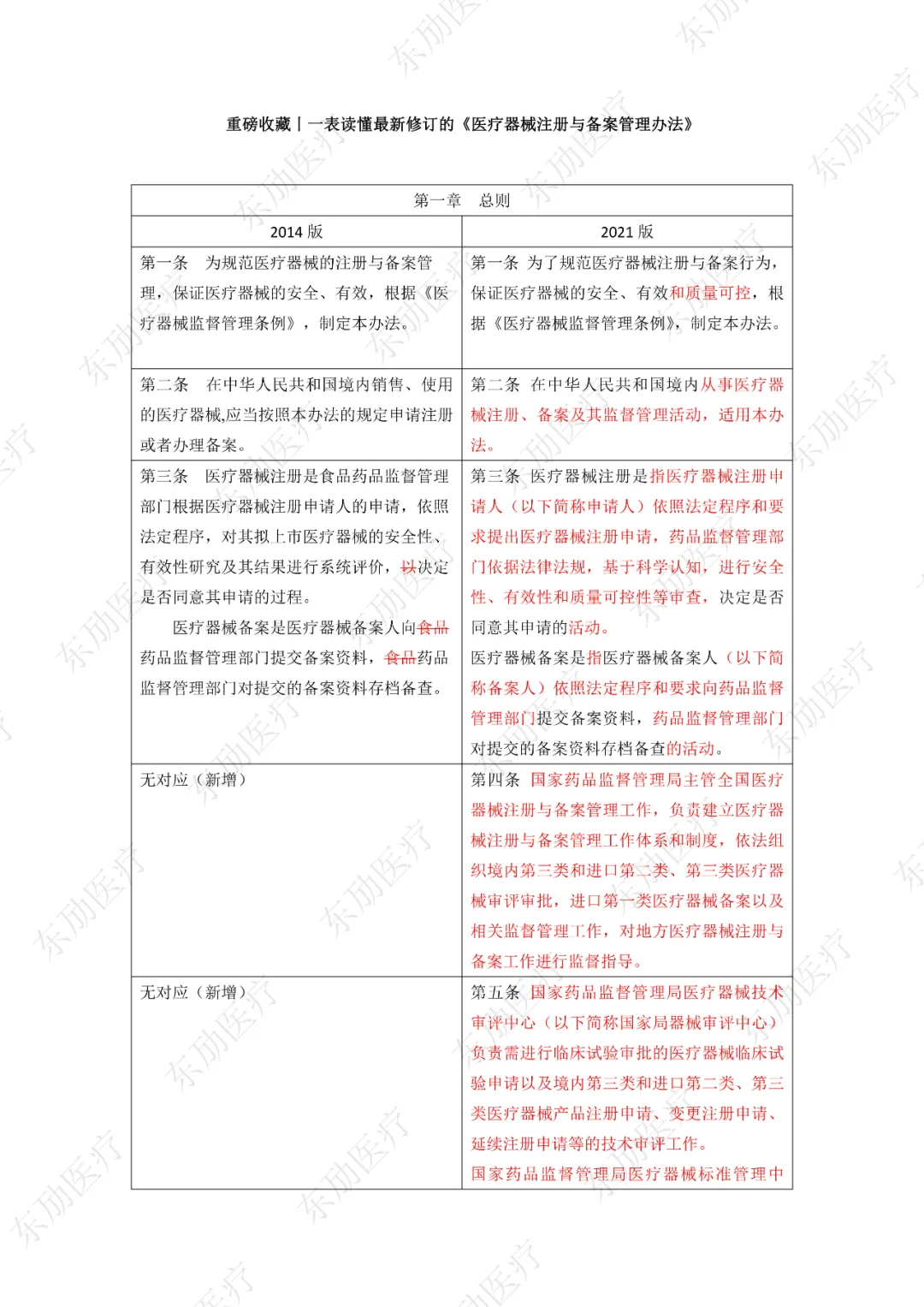
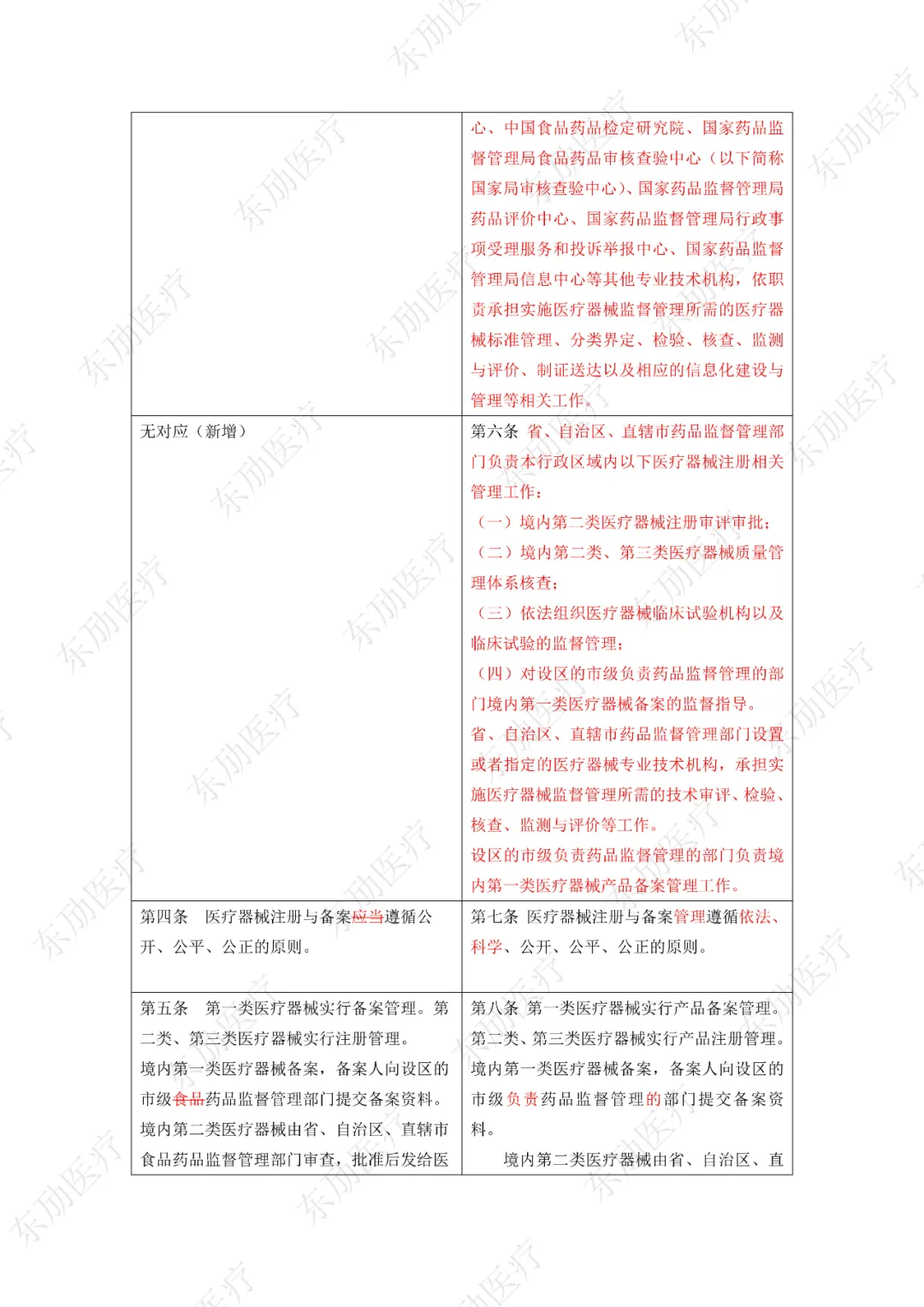
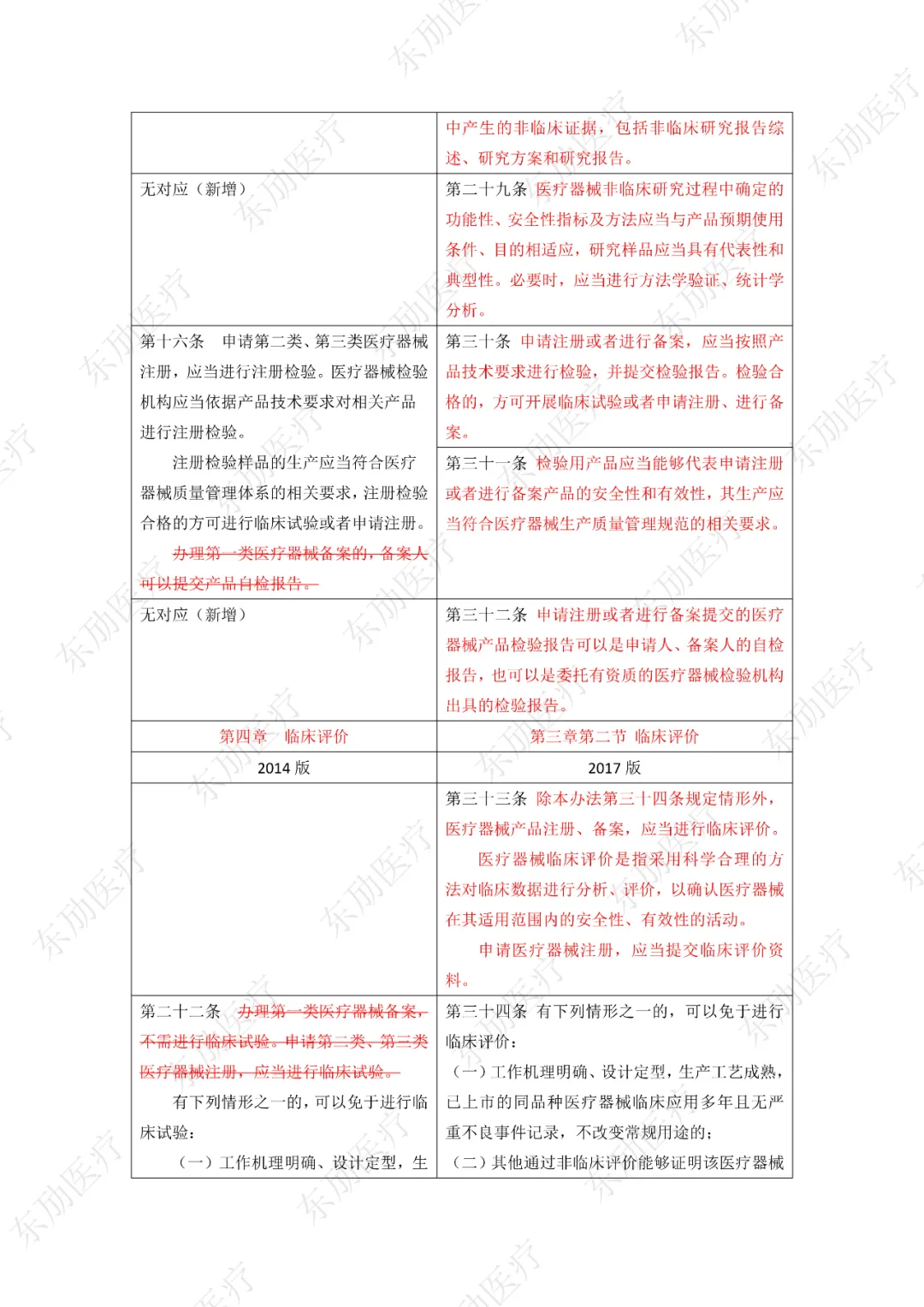
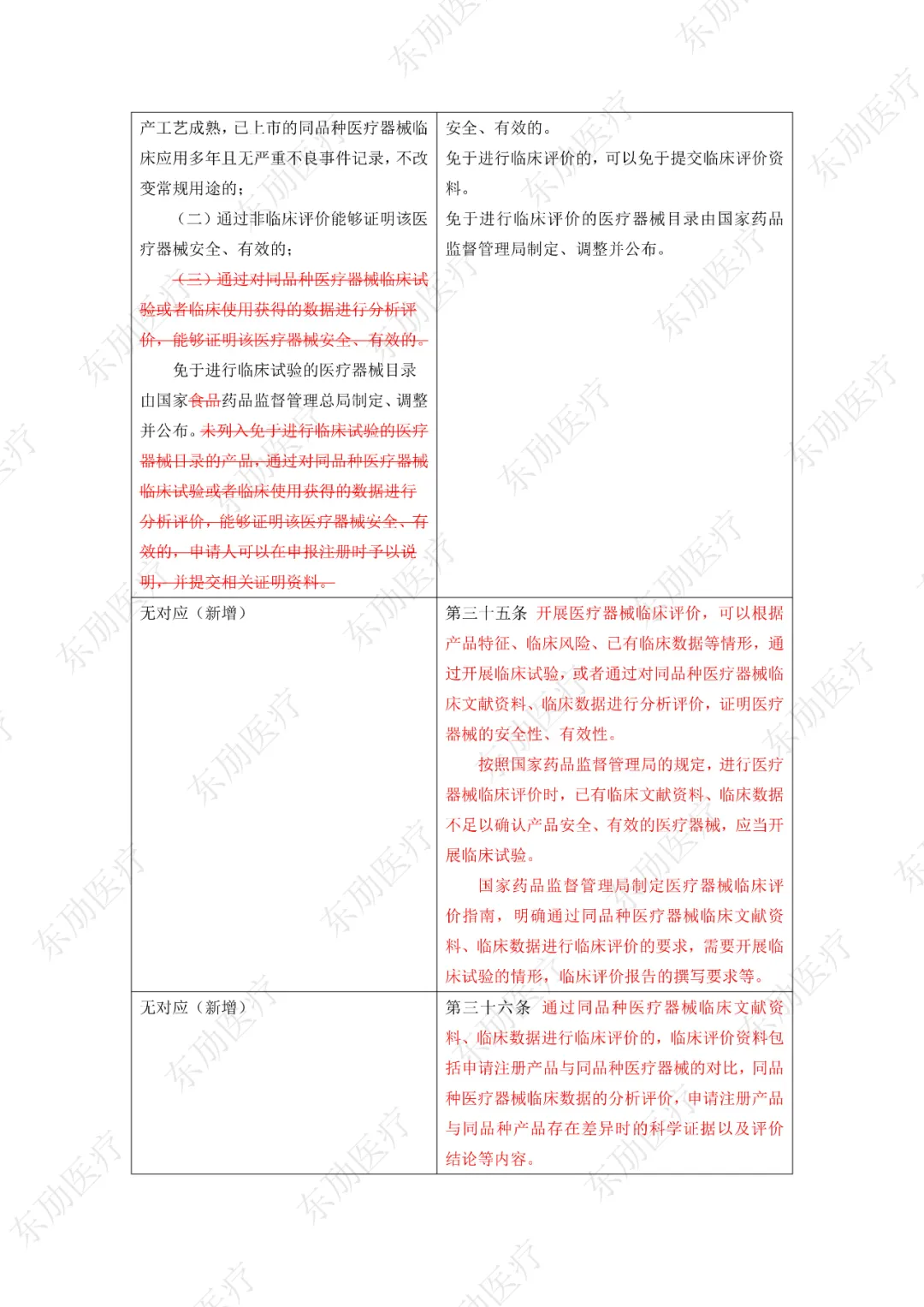
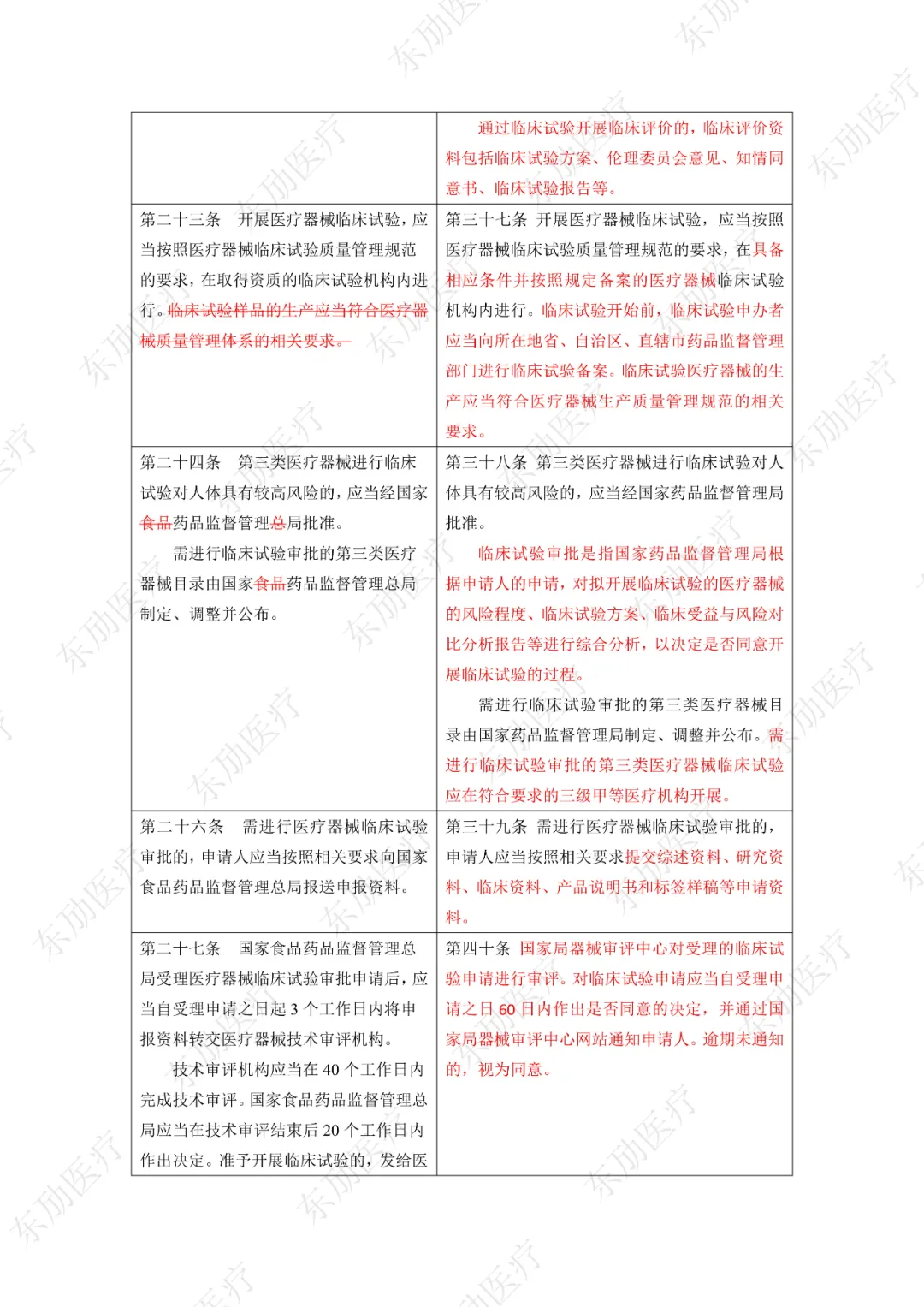
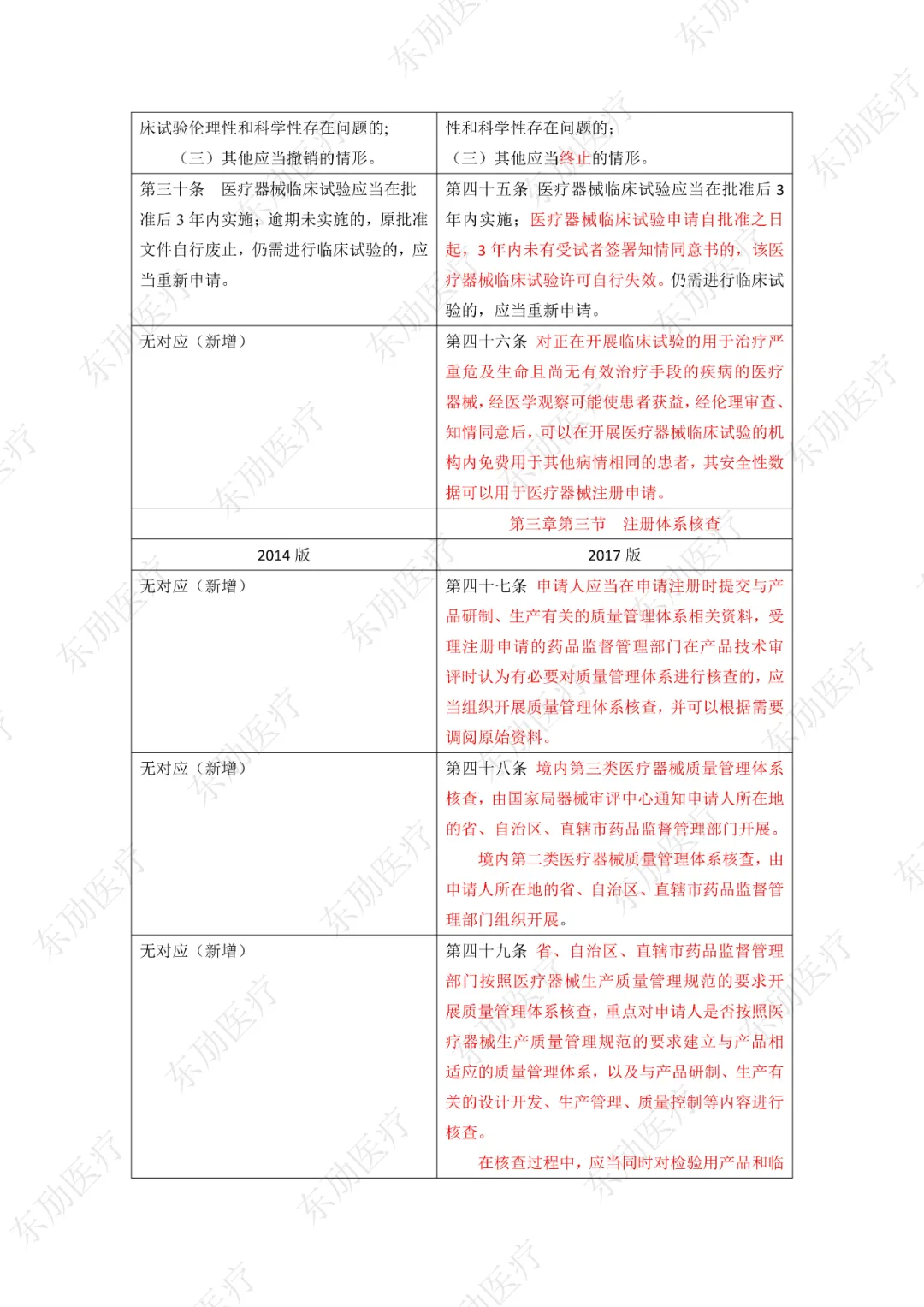
下附详细对照表
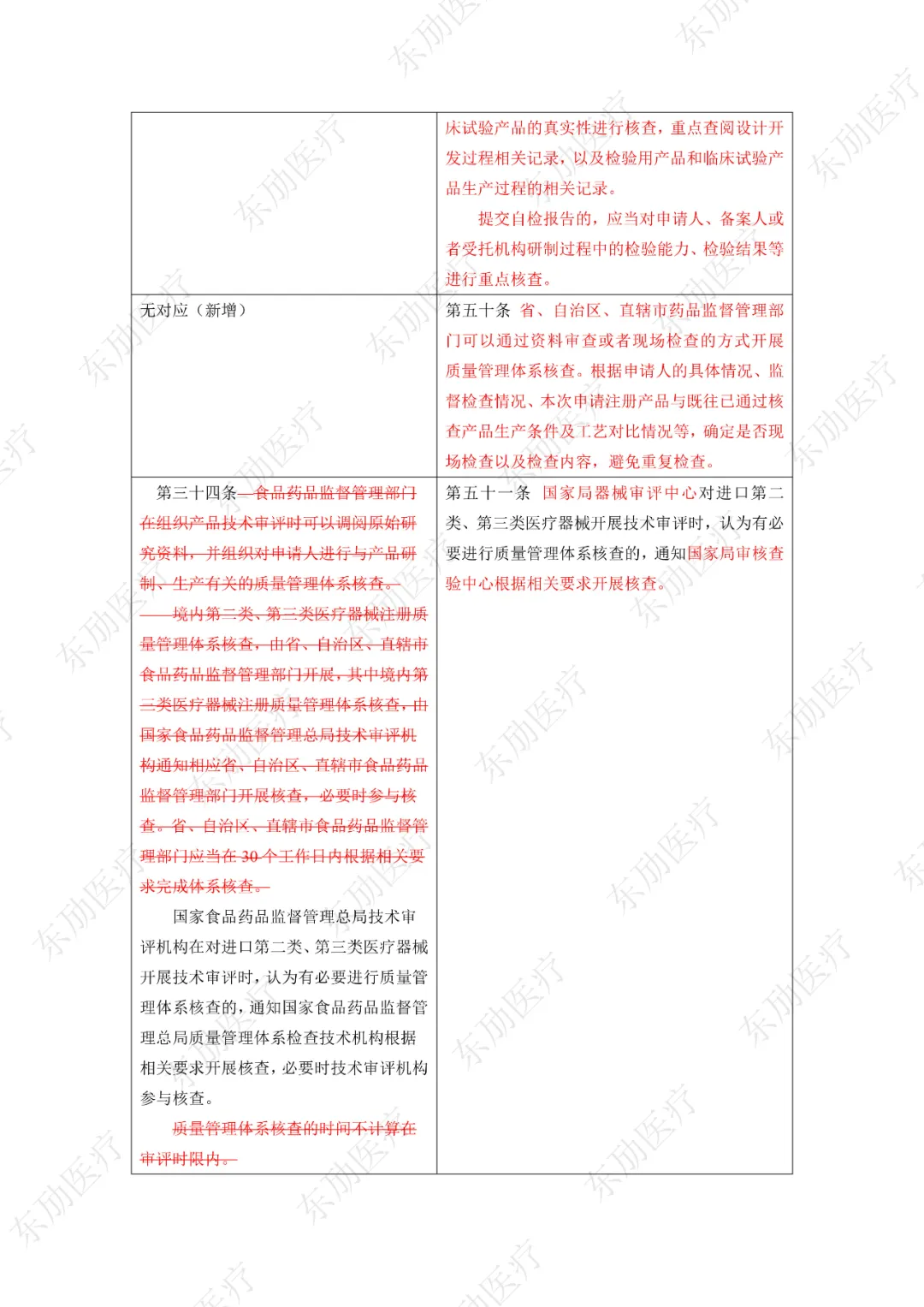
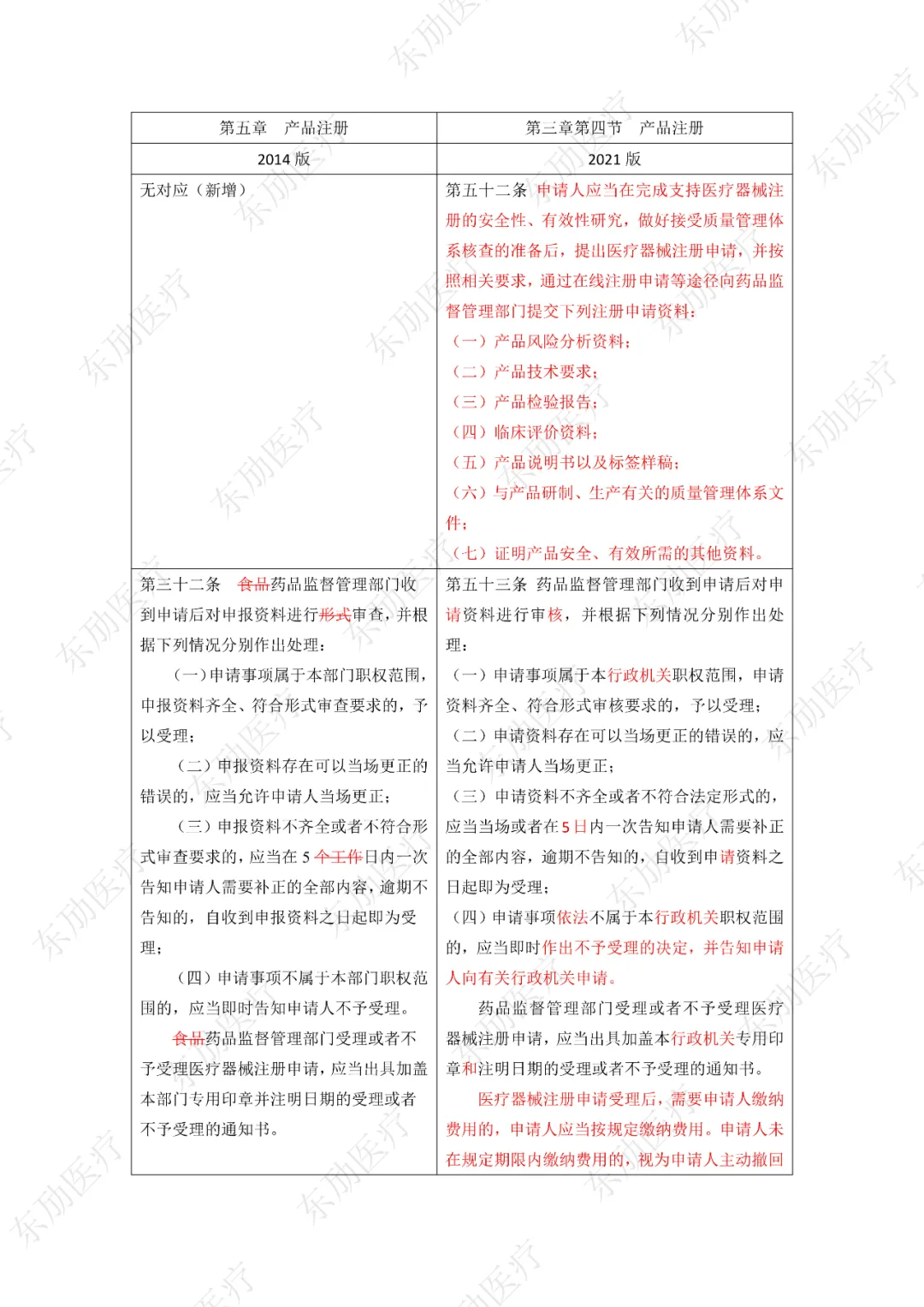
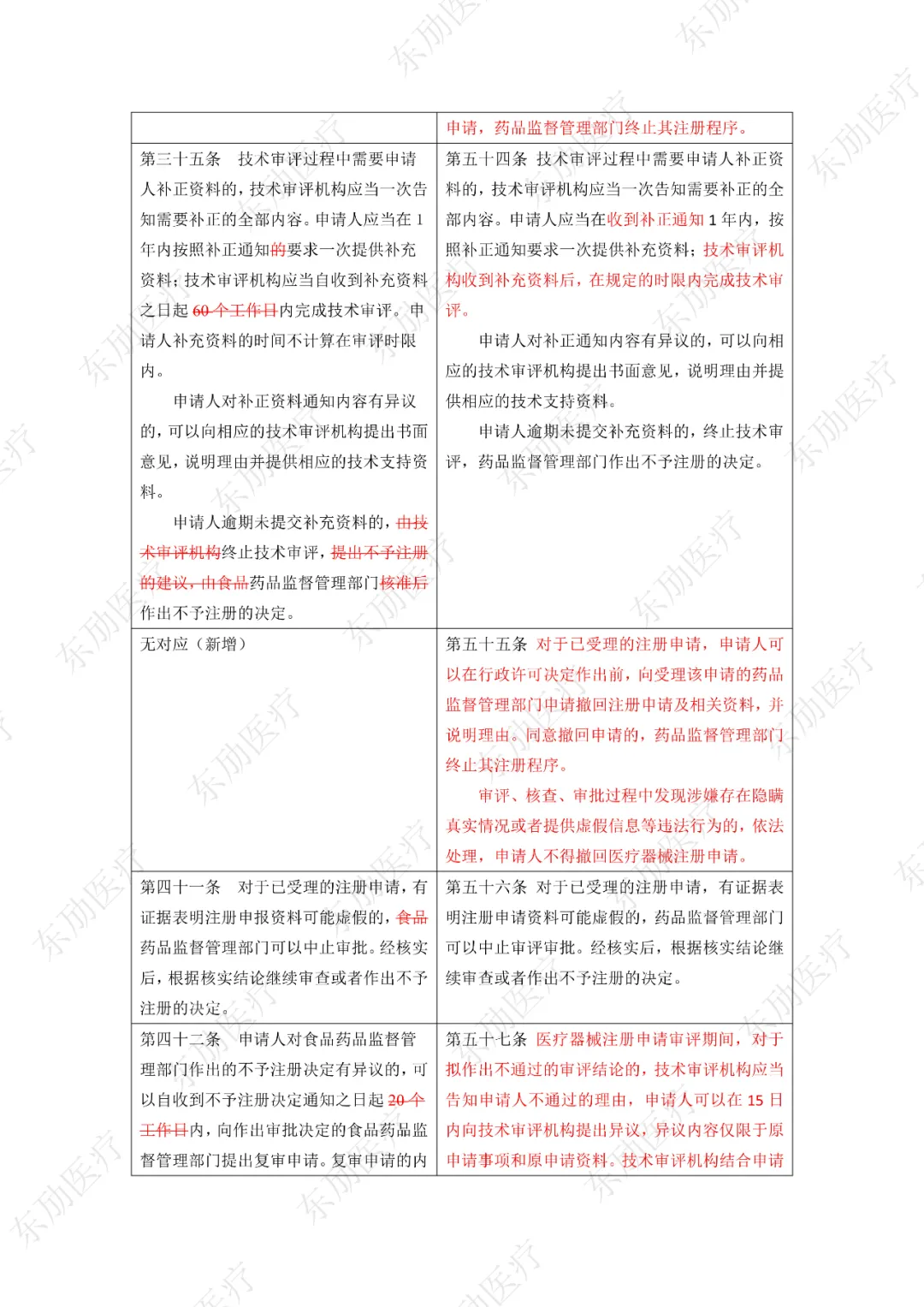
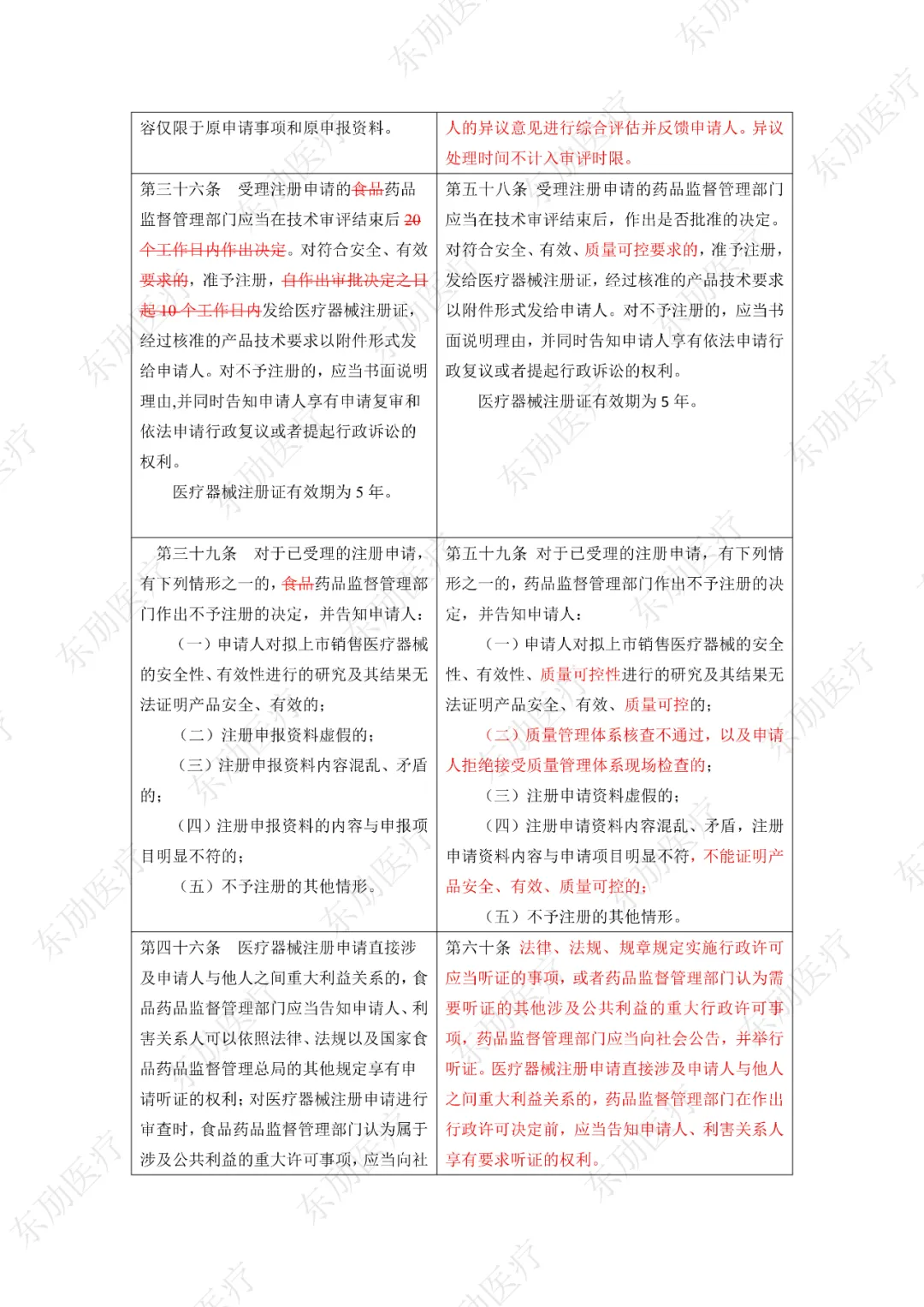
注:红色为删除内容;红色为修改内容。


来源:中国医疗器械行业协会











