我国创新医疗器械特别审批新进展概览
2019-07-10
创新医疗器械审批现状

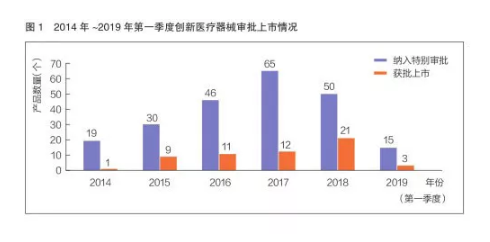
《创新医疗器械特别审批程序(试行)》(2017年修订为《创新医疗器械特别审查程序》)实施以来,截至今年第一季度,我国已有225个产品进入创新医疗器械特别审查通道,其中57个创新医疗器械通过特别审查程序上市。这些产品多为国内首创、国际原创或具有重大技术提升,填补了相关领域的空白。其中,今年一季度有15个产品纳入创新医疗器械特别审查程序,有3个产品获批上市。
从产品获批情况来看,2014年至今年第一季度,每年通过创新医疗器械特别审查程序上市的产品数量呈持续增长态势。创新产品从研发到上市的时间进一步缩短。据统计,创新医疗器械产品的审评审批时间较其他普通三类首次注册产品平均缩短83天。
产业大省(市)领跑
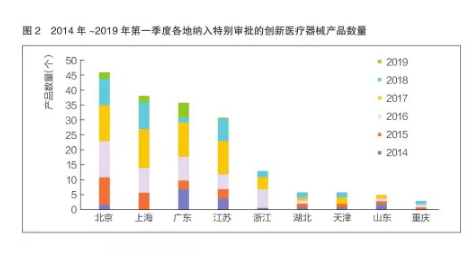
从产品获批的地域来看,北、上、广、苏四个产业大省(市)被纳入特别审批的创新医疗器械数量处于第一梯队(进口产品除外),其中北京有46个,高居首位,上海有38个、广东36个、江苏31个。另外,北京获批产品数量同样居首位,有19个,上海11个、广东10个、江苏8个。
分析北京在加速创新医疗器械上市方面处于领先地位的原因有以下几点:
一是北京市药品监管部门对初创企业产品质量体系进行了提前指导和规范,使得对企业进行质量体系核查所需时限大大缩短,由原先的30日缩短为6日;
二是在产品检验环节,北京市医疗器械检验所对所有创新医疗器械产品检验实行优先服务,一些科技含量较高的大型医疗器械检验周期由过去的将近3个月缩短为一个半月,所有创新产品检验周期平均缩短1/3以上;
三是北京市药监部门还对职责范围内的第二类创新医疗器械审批开通了绿色通道,使全流程审批时限由170天缩短至平均22天。
创新医疗器械审批现状
从产品类型上看,创新医疗器械获批产品以植/介入性医疗器械等高值耗材为主的产品占比最高,尤其是血管介入类产品中的血管支架。
目前已有4款血管支架通过创新医疗器械特别审查程序上市,分别为上海微创医疗器械(集团)有限公司的分支型主动脉覆膜支架及输送系统、北京华脉泰科医疗器械有限公司的腹主动脉覆膜支架系统、乐普(北京)医疗器械股份有限公司的生物可吸收冠状动脉雷帕霉素洗脱支架系统、上海微创心脉医疗科技股份有限公司的腹主动脉覆膜支架及输送系统。2017年,上海百心安生物技术有限公司、北京阿迈特医疗器械有限公司、深圳市信立泰生物医疗工程有限公司和上海脉全医疗器械有限公司的生物可吸收冠状动脉雷帕霉素洗脱支架系统也被纳入了特别审查程序。这也意味着我国血管支架产业的竞争力已经处于全球领先地位,在众多高端医疗器械中有望最先实现进口替代。
另外,体外诊断、医学成像等领域的首创重磅产品也不断获批。
厦门艾德生物医药科技股份有限公司的“人类10基因突变联合检测试剂盒(可逆末端终止测序法)”(维惠健)是首个跨癌种的NGS(新一代测序)伴随诊断产品,检测范围覆盖了肺癌、结直肠癌目前已上市的所有靶向药物需要检测的基因。
上海联影医疗科技有限公司自主研发了我国首台一体化正电子发射断层扫描及磁共振成像系统,获批上市后在复旦大学附属中山医院正式装机应用,填补了国内该领域的空白。
申请人获批情况
在180多家公司中,上海微创医疗及其子公司被纳入创新医疗器械特别审批的数量较多,共有15个产品,其中5个产品已获批上市,包括2个电生理产品、2个覆膜支架和1个血管重建装置。
先健科技(深圳)有限公司共有8个产品被纳入特别审批,其中左心耳封堵器系统和植入式心脏起搏器分别于2017年6月和12月获批上市,在国内封堵器和心脏起搏器领域建立了明显优势。北京品驰医疗设备有限公司有2套神经刺激电极套件获批,上海联影申请的4个医学成像创新医疗器械中有2个已获批,博奥生物集团有限公司的2个核酸检测产品均获批,艾德生物的2个基因检测试剂盒也已获批。
创新医疗器械认证和获批的数量和时间,均能反映出我国创新医疗器械审批政策的实施对加速创新医疗器械上市具有推动作用。从行业监管的角度来说,各地监管部门可以参考借鉴北京、上海等地加速审评审批的经验,加强本地区医疗器械的创新和产品上市。











