质量管理
- 2022.01.06
独家|如何让你的全球性医疗器械翻译内容更加本地化?
通过多语言医疗器械标识的严苛标准会很难。实现这一目标需要准确的翻译、本地化、测试和验证。当然,关键是提前计划和充分准备……
阅读更多 - 2022.01.05
无菌医疗器械生产质量管理规范检查要点指南
本指南可作为北京市药品监督管理局组织、实施的医疗器械注册质量管理体系现场核查、《医疗器械生产许可证》现场核查、医疗器械生产监督检查等各项检查的参考资料……
阅读更多 - 2021.12.09
七个改进质量的基本工具
只有了解解决问题或质量改进的基本过程,才能运用质量工具更快更系统地开展工作,下面介绍了七个改进质量的基本工具……
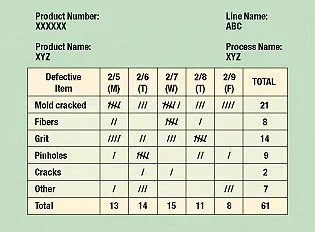
阅读更多 - 2021.12.03
医疗器械注册是否必须取得ISO13485认证证书?
首先说一下答案,答案是不需要。申请医疗器械注册证不是必须提供ISO13485认证证书。只是你们公司拿注册证是必须通过药监局的体系考核的(专业名词是GMP体系),该体系考核和ISO13485差不了多少……

阅读更多 - 2021.11.23
医疗器械注册体系审核是如何进行体系核查的
经历过体系考核的人都知道,一般来体考的审核员至少有2名,其中1名组长,1名组员,审核时间至少为1天时间,审核员要在1天之内对企业进行全面的核查,并作出是否合规的评价,必须抓审核重点,本文总结了一些审核要点,仅供参考……
阅读更多 - 2021.11.22
医用胶粘剂的标准及应用
医疗级胶粘剂是指用作医疗器械粘接的胶粘剂。现在很多种类的医疗器械都需要依靠胶粘剂来组装剂。现代医疗器械制造工业要求最终产品在很多特殊条件下具有最大的可靠性和性能……

阅读更多 -
如何通过实验确定医疗器械使用期限?
医疗器械注册申报时要明确产品的使用期限。对于有硬件设备的有源设备来说,使用期限的确定要根据产品实际试验情况而定,而像软件这类没有实体的有源设备……
阅读更多 - 2021.11.17
六条标准告诉你激光切割机切割质量如何看?
激光切割机的质量好坏主要看其切割质量,这是检验设备质量最直接的办法。对于新客户来讲,在购买设备的时候都会要求先看激光切割机打样,打样除了看设备的切割速度……

阅读更多 - 2021.09.29
通过医疗设备制造中的质量管理降低风险
不存在完全无风险的医疗设备。而且,在制造医疗设备时,人们往往并不重视风险管理。产品缺陷对于消费者的健康和安全而言,就像一颗定时炸弹,对于生产这些设备的公司来说,同样也是潜在隐患……

阅读更多 - 2021.08.23
避坑指南:30个常见的电磁兼容EMC问题
为什么要对产品做电磁兼容设计?对产品做电磁兼容设计可以从哪几个方面进行?在电磁兼容领域,为什么总是用分贝(dB)的单位描述……
阅读更多

















