医疗器械设计控制详解
2021-06-21
设计控制的概念始于FDA,FDA发现设计控制的不足是造成医疗器械召回的主要原因之一。此后,设计控制,采购控制,生产和过程控制构成了产品实现过程中的主要控制过程。
1. 什么是设计控制?
通过设计控制确保医疗器械满足
• 预期用途
• 用户需求
• 具体要求
确保医疗器械的设计能够有效的转换到生产制造。
2. 法规的要求
• US CFR,Title21,Part820.30
适用于所有ClassII,ClassIII 医疗器械,及部分ClassI 医疗器械
• ISO13485中第7.3章节
• 医疗器械生产质量管理规范第28条~38条
第二十八条 企业应当建立设计控制程序并形成文件,对医疗器械的设计和开发过程实施策划和控制。
第二十九条 在进行设计和开发策划时,应当确定设计和开发的阶段及对各阶段的评审、验证、确认和设计转换等活动,应当识别和确定各个部门设计和开发的活动和接口,明确职责和分工。
第三十条 设计和开发输入应当包括预期用途规定的功能、性能和安全要求、法规要求、风险管理控制措施和其他要求。对设计和开发输入应当进行评审并得到批准,保持相关记录。
第三十一条 *设计和开发输出应当满足输入要求,包括采购、生产和服务所需的相关信息、产品技术要求等。设计和开发输出应当得到批准,保持相关记录。
第三十二条 企业应当在设计和开发过程中开展设计和开发到生产的转换活动,以使设计和开发的输出在成为最终产品规范前得以验证,确保设计和开发输出适用于生产。
第三十三条 企业应当在设计和开发的适宜阶段安排评审,保持评审结果及任何必要措施的记录。
第三十四条 企业应当对设计和开发进行验证,以确保设计和开发输出满足输入的要求,并保持验证结果和任何必要措施的记录。
第三十五条 企业应当对设计和开发进行确认,以确保产品满足规定的使用要求或者预期用途的要求,并保持确认结果和任何必要措施的记录。
第三十六条 确认可采用临床评价或者性能评价。进行临床试验时应当符合医疗器械临床试验法规的要求。
第三十七条 企业应当对设计和开发的更改进行识别并保持记录。必要时,应当对设计和开发更改进行评审、验证和确认,并在实施前得到批准。
*当选用的材料、零件或者产品功能的改变可能影响到医疗器械产品安全性、有效性时,应当评价因改动可能带来的风险,必要时采取措施将风险降低到可接受水平,同时应当符合相关法规的要求。
第三十八条 企业应当在包括设计和开发在内的产品实现全过程中,制定风险管理的要求并形成文件,保持相关记录。
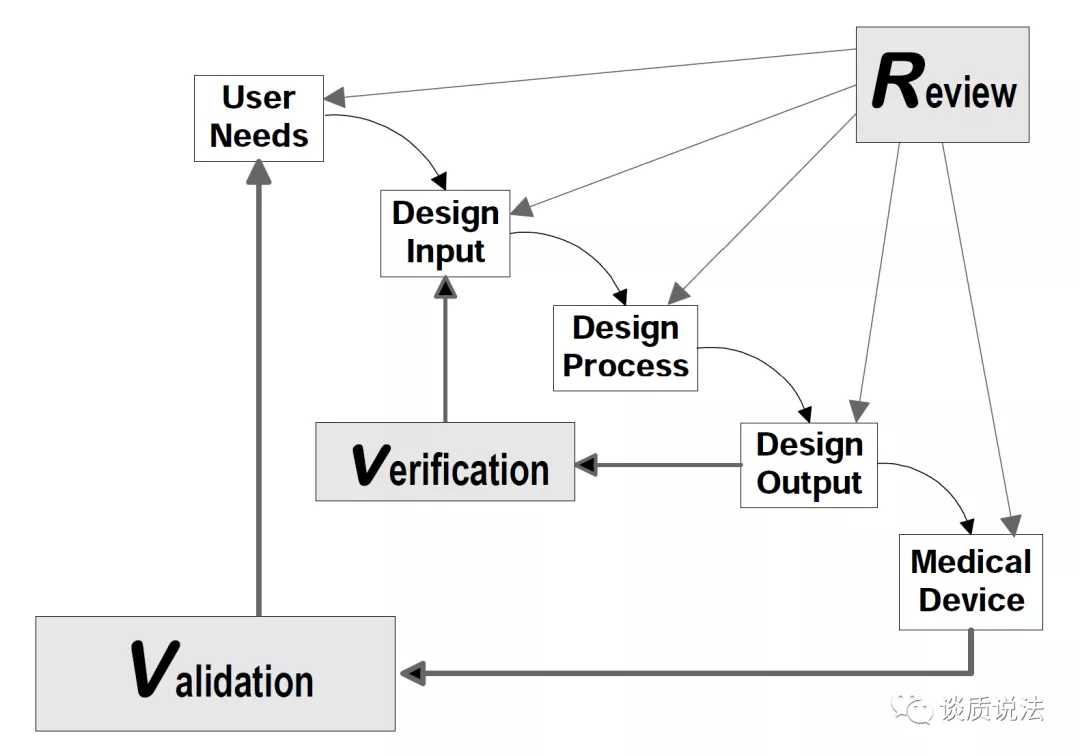
3. 设计控制框架
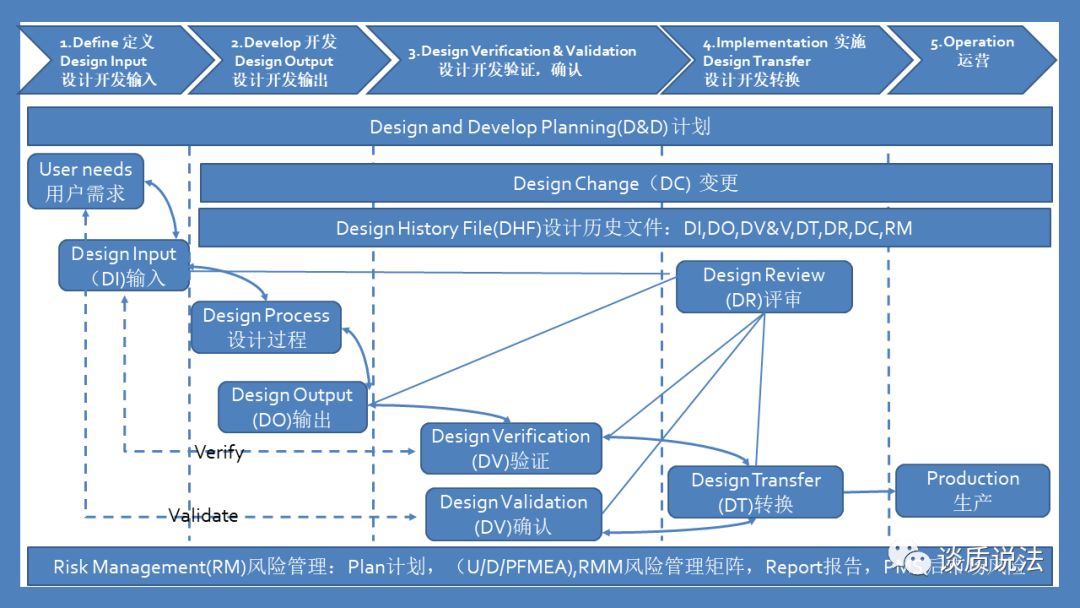
精心策划的设计控制流程是保证医疗器械能够满足预期用途、用户需求和具体要求的手段。

计划永远先行,一切行动按计划行事。
设计开发策划贯穿产品设计开发整个生命周期,用于指导如何实现产品从概念到上市的总章。

法规的要求
• 21 CFR820.30(b)
• ISO13485中的7.3.2条款
• 中国的《医疗器械生产质量管理规范》中的条款28和29
21 CFR820.30(b)
Each manufacturer shall establish and maintain plans that describe or reference the design and development activities and define responsibility for implementation.
每个制造商应建立并维护设计开发策划用于描述或引用设计开发活动并明确实施的职责。
The plans shall identify and describe the interfaces with different groups or activitiesthat provide, or result in, input to the design and development process.
计划应识别并描述不同小组或活动之间的接口,这些接口为设计和开发过程提供或产生输入。
The plans shall be reviewed, updated, and approved as design and development evolves.
随着设计开发的展开,计划应被评审,更新,批准。
Clause7.3.2 of ISO 13485
The organization shall plan and control the design and development of product. Asappropriate, design and development planning documents shall be maintained andupdated as the design and development progresses.
组织应对产品的设计和开发进行策划和控制。适当时,伴随设计和开发的进程,应保持并更新设计和开发策划文件。
During design and development planning, the organization shall document:
a)the design and development stages; 设计和开发阶段;
b)the review(s) needed at each design and development stage; 每个设计和开发阶段的评审
c)the verification, validation, and design transfer activities that appropriate at each design and development stage
每个设计和开发阶段的验证,确认,和设计转换活动。
d)the responsibilities and authorities for design and development;
设计和开发的职责和权限
e)the methods to ensure traceability of design and development outputs to design and development inputs;
确保设计和开发输出到设计和开发输入的可追溯方法
f)the resources needed,including necessary competence of personnel.
所需的资源,包括必要的人员能力。
China GMP条款28、29
28.企业应当建立设计控制程序并形成文件,对医疗器械的设计和开发过程实施策划和控制。
29.在进行设计和开发策划时,应当确定设计和开发的阶段及对各阶段的评审、验证、确认和设计转换等活动,应当识别和确定各个部门设计和开发的活动和接口,明确职责和分工。
法规解析
法规要求共同点:
• 应建立设计控制程序及对产品设计开发策划和控制
• 应确定设计和开发的阶段及对各阶段的评审、验证、确认和设计转换等活动
• 明确职责和分工
法规要求差异:
• 应当识别和确定各个部门设计和开发的活动和接口,
(820.30b/China GMP有相应要求,ISO13485 未提及)
• 确保设计和开发输出到设计和开发输入的可追溯方法 (ISO13485 具体要求)
• 所需的资源,包括必要的人员能力(ISO13485 具体要求)
关于人员能力,820.25 Personnel 有统一的要求,China GMP 第二章机构和人员中第6~8条款有统一的要求。
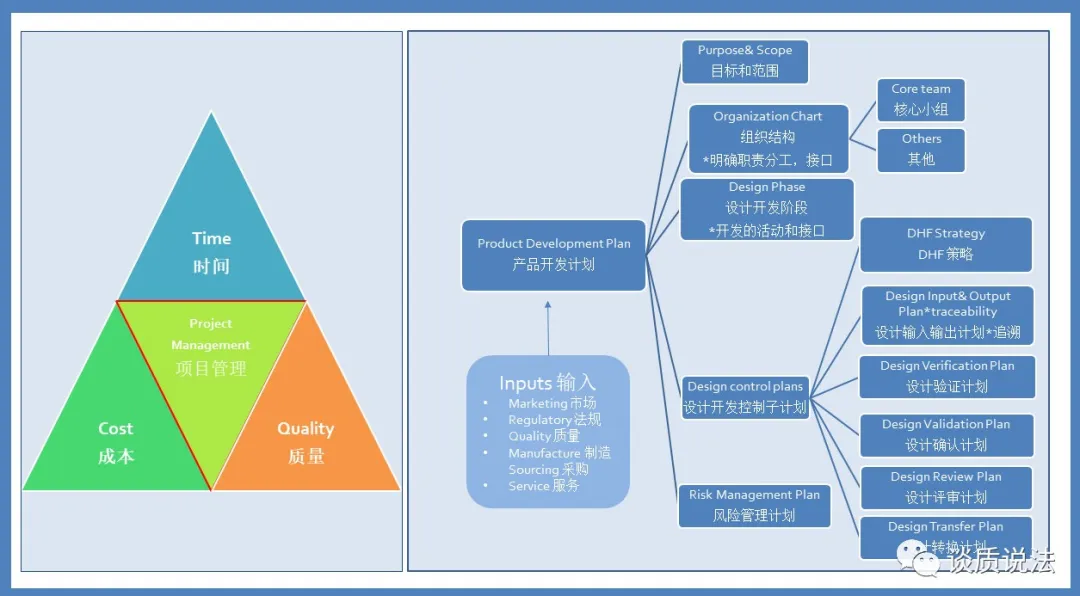
设计开发策划
通常产品设计开发是通过项目运行的方式进行的,这样我们面对的一个问题就是,项目计划和设计开发策划是不是一回事,在实际运行中要怎样做才是行之有效的。小编观点如下,
1. 设计开发策划是法规的要求,是产品DHF 的一部分。
2. 而项目计划是项目管理的一个重要输出,策划项目启动到结束整个过程包括时间,成本,质量的运作。
3. 把项目开发策划的内容集合到了项目计划中也是可行的,但不推荐。
设计开发输入
简单通俗的理解,输入就是需求包括来源于客户的需求及分解到产品的需求。
法规的要求
• QSR820
820.3(f) Design input means the physical and performance requirements of a device that areused as a basis for device design. 设计输入是作为器械设计基础的对器械实体和性能的要求。
820.30(c)Design input 设计输入
Each manufacturer shall establish andmaintain procedures to ensure that the design requirements relating to a deviceare appropriate and address the intended use of the device, including the needsof the user and patient. 制造商应建立和维护程序以确保与器械相关的设计要求是事宜的,并且反映了包括使用者和患者需求的预期用途。
The procedures shall include a mechanismfor addressing incomplete, ambiguous, or conflicting requirements. 程序应包括处理不完整,不清晰和互相矛盾要求的机制。
The design input requirements shall bedocumented and shall be reviewed and approved by a designated individual(s).The approval, including the date and signature of the individual(s) approvingthe requirements, shall be documented.设计输入要求应形成文件,并由指定人员评审和批准。包括批准日期和批准人签名的批准信息应形成文件。
• ISO13485
7.3.3 Design and development inputs 设计和开发输入
Inputs relating to product requirements shall be determinedand records maintained (see 4.2.5). These inputs shall include: 产品需求的输入应被决定并记录。这些输入应包括:
a)functional, performance, usability and safety requirements, according to theintended use; 根据预期用途确定的功能,性能,可用性和安全需求
b)applicable regulatory requirements and standards;适用的法规和标准要求
c)applicable output(s) of risk management;适用的风险管理的输出
d)asappropriate, information derived from previous similar designs;来源于以前类似设计的信息
e) other requirements essential for design and development of the product and processes.产品和过程的设计和开发所必须的其他要求
These inputs shall be reviewed for adequacy and approved.设计和
开发输入应被充分评审并批准。
Requirements shall be complete, unambiguous, able to be verified or validated, and not in conflict with each other. 需求应是完整的,清楚的,能够被验证或确认,并且不相互冲突的。
• China GMP 第三十条
设计和开发输入应当包括预期用途规定的功能、性能和安全要求、法规要求、风险管理控制措施和其他要求。对设计和开发输入应当进行评审并得到批准,保持相关记录。
法规的解析
• 共同点
设计和开发输入应被识别,记录,评审,并批准;
设计和开发输入应包括产品的预期用途,及功能、性能和安全要求、法规要求、风险管理控制措施和其他要求。
• 差异点
QSR820/ISO13485明确需求应完整的,清楚的,不相互矛盾的。ISO13485中同时明确需求是能够被验证或确认的。China GMP 中没有相关要求说明。
ISO13485/ChinaGMP明确指出风险管理与设计输入的关联,风险控制措施是设计输入的一部分,QSR820 中没有明确说明。
设计开发输入
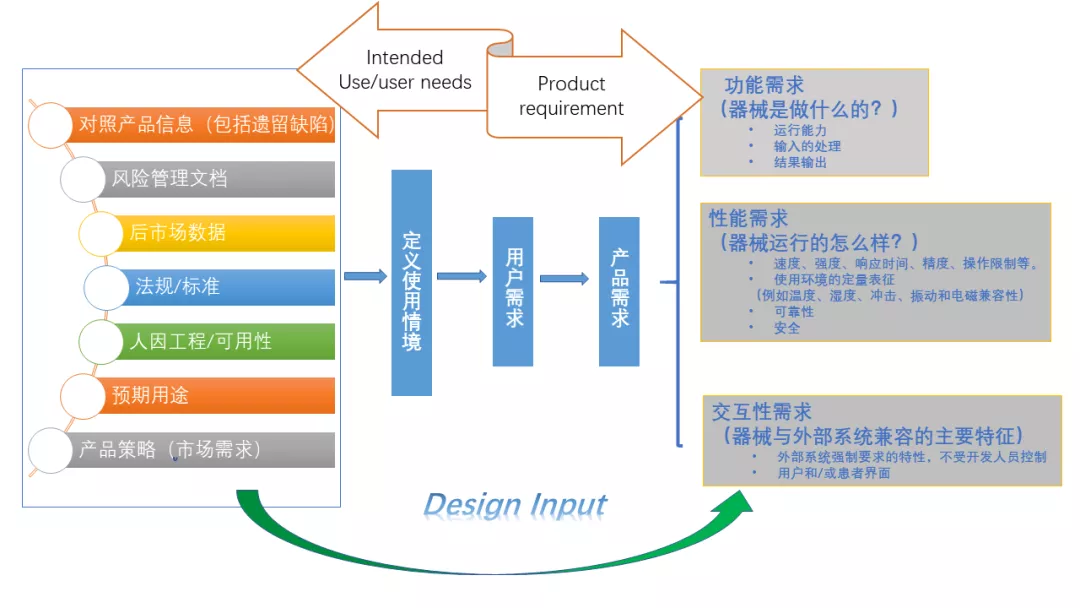
设计开发的输入定义得到是从产品预期用途到产品的需求。如何确定设计开发输入应考虑包括市场策略,预期使用情景,人因工程,可用性,适用的法规标准,对照品的产品信息如后市场数据(遗留的产品缺陷,投诉,不良事件等),评审各个因素并确定产品需求包括各种不同类型的需求如功能性需求,性能需求及交互性需求。然后再对产品需求进行分解至子系统需求。
法规的要求
QSR820
820.3(g)
Design outputs means the results of a design effort at each design phase and at the end of the total design effort.
820.3(g)设计输出是指各设计阶段的设计成果和最终的总设计成果。完整的设计输出包括器械,包装和标签,器械主记录。
820.30(d) Design output
Each manufacturer shall establish and maintain procedures for defining and documenting design output in terms that allow an adequate evaluation of conformance to design input requirements. Design output procedures shall contain or make reference to acceptance criteria and shall ensure that those design outputs that are essential for the proper functioning of the device are identified. Design output shall be documented, reviewed, and approved before release. The approval, including the date and signature of the individual(s) approving the output, shall be documented.
820.30 (d)设计输出
制造商应建立、维护用于定义和编制设计输出文件的程序,以便充分地进行设计输出是否满足设计输入要求的评价。设计输出程序应包含或索引到可接受准则并确保为器械正常的工作必不可少的设计输出被识别出来。设计输出应形成文件、进行审评并在批准后生效。同步记录审评、批准人员和批准日期信息。
ISO 13485
7.3.4 Design and development outputs 设计和开发输出
Design and development outputs shall:
a) meet the input requirements for design and development;
b) provide appropriate information for purchasing, production and service provision;
c) contain or reference product acceptance criteria;
d) specify the characteristics of the product that are essential for its safe and proper use.
The outputs of design and development shallbe in a form suitable for verification against the design and development inputs and shall be approved prior to release.
Records of the design and developmentoutputs shall be maintained.
设计和开发输出应:
a. 满足设计和开发输入的要求;
b. 提供适当的信息给采购,生产,服务;
c. 包括或引用产品接收准则;
d. 规定产品特性,该特性对于产品的安全和正确使用是必需的。
设计和开发的输出应采用适合于对照设计和开发输入进行验证的形式,并应在发布前获得批准。应保存设计和开发输出的记录。
China GMP
第三十一条 设计和开发输出应当满足输入要求,包括采购、生产和服务所需的相关信息、产品技术要求等。设计和开发输出应当得到批准,保持相关记录。
第三十二条 企业应当在设计和开发过程中开展设计和开发到生产的转换活动,以使设计和开发的输出在成为最终产品规范前得以验证,确保设计和开发输出适用于生产。
法规的解析
• 共同点
设计开发输出应该被记录。
设计开发输出应该满足设计开发输入的要求。
• 差异点
QSR820 特有要求
为确保器械正常的工作必不可少的设计输出被识别出来
QSR820/ISO13485
设计开发输出应包括或引用产品接收标准
ISO 13485
识别规定产品特性,该特性对于产品的安全和正确使用是必要的。
ISO 13485/China GMP
设计开发输出包括采购、生产和服务所需的相关信息。
China GMP
设计开发输出包括产品技术要求;设计和开发的输出在成为最终产品规范前得
以验证,确保设计和开发输出适用于生产。
设计开发输出
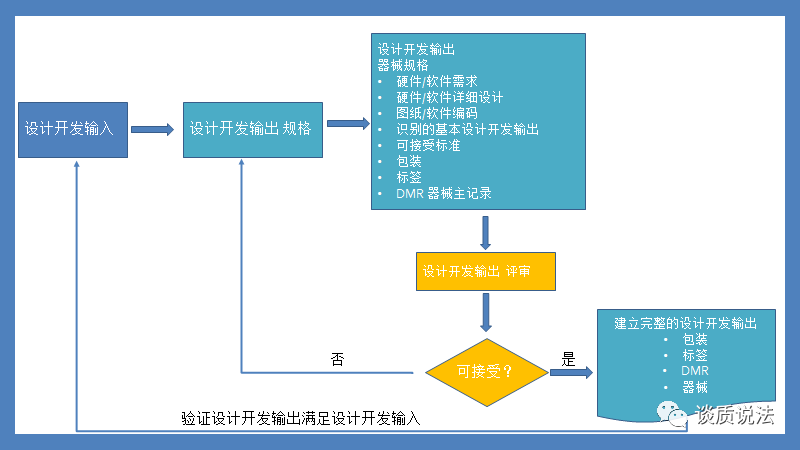
设计开发输出既有文件层面的各个低层次的需求,详细设计,图纸,软件编码,包装,说明书,标签等,也有如以实物形式存在的系统,子系统,零件,包装箱等。
我们经常说的“设计输出(design output)”,比如研发部门做出来的设计方案、机械图纸、电路图、软件代码,实际上是狭义的Design Output!真正意义上 的 Design Output 还包括用于生产的DMR(Device Master Record)。这个广义的概念也正是开篇中FDA 要求中说到的 “total finished design output”。
一般而言DMR可能包括:
• DMR目录
• 产品技术规格
• 原理图
• 部件清单
• 采购文件(包括部件规格等)
• 生产过程规范(制造工艺SOP,组装作业指导书,连接示意图,软件配置等)
• 标识信息(清洁方法,存储条件,安全和警告标签)
• 产品控制文件(检验规程以及可接受准则)
• 包装规格
• 安装和维护信息
在了解设计开发输入和设计开发输出后,接下来我们再继续了解连接输出和输入的纽带即设计开发验证。设计开发验证用以确保设计开发输出满足设计开发输入要求。
法规的要求
QSR 820
820.30(f)Design verification 设计开发验证
Each manufacturer shall establish and maintain procedures for verifying the device design. Design verification shall confirm that the design output meets the design input requirements. The results of the design verification, including identification of the design, method(s), the date, and the individual(s) performing theverification, shall be documented in the DHF.
制造商应建立并保持验证器械设计的程序。设计验证应证明设计输出达到设计输入要求。设计验证的结果,包括设计方法的鉴定,验证人员和日期,都应当记录在DHF文件中。
ISO 13485
7.3.6 Designand development verification 设计和开发验证
Design and development verification shall be performed in accordance with planned and documented arrangements to ensure that the design and development outputshave met the design and development input requirements.
The organization shall document verification plans that include methods,acceptance criteria and, as appropriate, statistical techniques withrationale for sample size.
If the intendeduse requires that the medical device be connected to, or have aninterface with, other medical device(s), verification shall include confirmation that the design outputs meet design inputs when so connectedor interfaced.
Records of theresults and conclusions of the verification and necessary actions shall bemaintained (see 4.2.4 and 4.2.5).
设计和开发验证应按策划和形成文件的安排进行,以确保设计和开发输出满足设计和开发输入要求。
组织应记录验证计划,包括方法、验收标准和(如适用)统计技术以及样本量的基本原理。
如果预期用途要求医疗器械与其他医疗器械连接或具有接口,则验证应包括确认当连接或接口时设计输出符合设计输入。
应保持验证结果和结论以及必要措施的记录(见4.2.4和4.2.5)。
China GMP
第三十四条 企业应当对设计和开发进行验证,以确保设计和开发输出满足输入的要求,并保持验证结果和任何必要措施的记录。
法规的解析
共同点
设计和开发进行验证,以确保设计和开发输出满足输入的要求。
记录验证结果。
差异点
ISO 13485 特有要求
如果预期用途要求医疗器械与其他医疗器械连接或具有接口,则验证应包括
确认当连接或接口时设计输出符合设计输入。
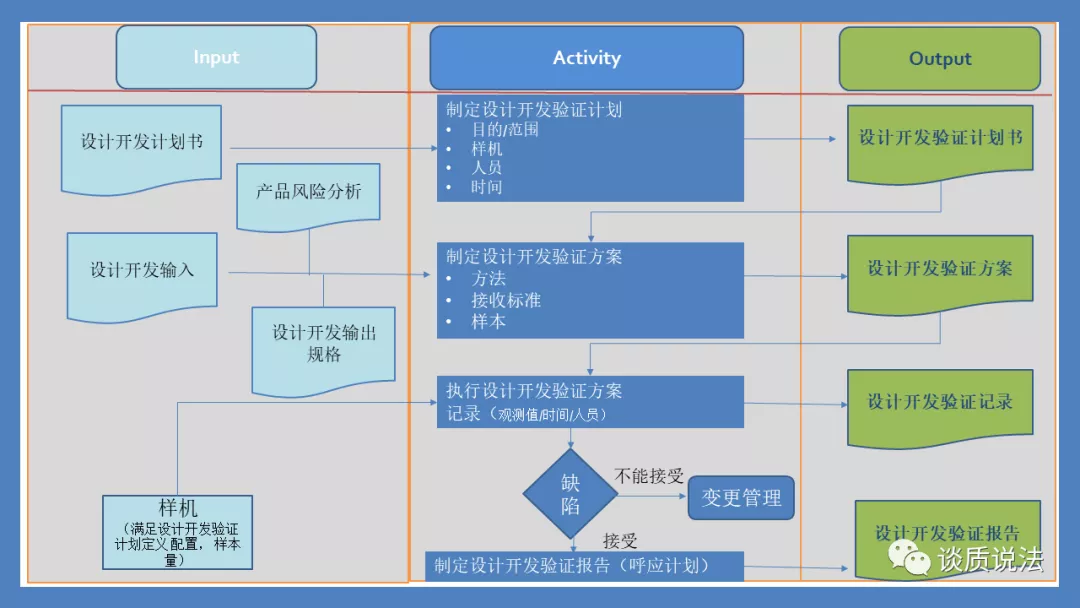
设计开发验证
设计开发验证的输出物主要包括设计开发验证计划书,设计开发验证方案,设计开发验证记录,及设计开发验证报告。
来源:香器械经销商联盟











