国际医疗器械展览会ERCP内镜:我们能做些什么来预防感染?
2022-10-17
过去的一年里,国际医疗器械展览会Medtec China 2022根据美国食品药品监督管理局(FDA)、美国疾病控制和预防中心(CDC)以及全国性新闻发布的多起疫情报告,意识到主要用于内镜下逆行胰胆管造影术(ERCP)的十二指肠镜的复杂设计可能阻碍有效的再处理。1,2最近的几篇文章包括本期ICHE中由Wendorf等人3撰写的论文认为,患者感染多重耐药(MDR)细菌尤其是耐碳青霉烯肠杆菌(CRE)的原因很可能是在接受ERCP时使用的经处理的十二指肠镜。3-5与其他内镜相关的爆发不同,即使正确遵循了制造商的说明和专业指南,这些十二指肠镜感染爆发依然发生了。因此如何进行再处理及灭菌成文当下研发的重点和难题。
本文有两个目的:
1讨论目前存在哪些其他方法可以提高十二指肠镜再处理的安全系数;
2讨论如何防止未来与ERCP内镜和其他消化(GI)内镜相关的感染。6
在本期的ICHE中,Wendorf等人报告了接受ERCP治疗的严重胆道疾病患者感染新型产AmpC大肠杆菌菌株事件。使用脉冲场凝胶电泳,发现8条经过处理的ERCP内镜中有2条的培养物中藏有产AmpC大肠杆菌,与患者的分离物相符。审查内镜再处理流程后并没有发现任何疏漏之处。
十二指肠镜的抬钳器管道是侧视式内镜所特有的。它将导管、导丝和附件导向内镜视野6。这个独立的管道设计复杂,有缝隙,清洗刷难以接触其表面,可能会阻碍有效的再处理。2根据这一特点和其他最近研究,MDR病原体很可能是一种“标记”或“指示”微生物,表明对于十二指肠镜的复杂设计,再处理是无效的,会给患者带来感染的风险。目前还不清楚与ERCP镜一样有抬钳器管道的超声内镜(导向性附件)是否也会造成消毒挑战和类似的感染风险;超声内镜用于进入原本无菌的空间来获得诊断样本和进行治疗性干预。
本研究和其他研究提出的关键问题有以下几点:目前的内镜再处理指南是否足以确保消化道内镜不存在潜在的病原体?对于具有狭长管道、直角转弯和严重微生物污染(107-1010个细菌)以及难以清洗消毒的部件(如抬钳器管道)的内镜,是否无法确保可靠的高水平消毒(HLD)?为了研究这些问题,我们简要回顾一下目前关于内镜再处理的知识,然后提出建议。首先,内镜是中度危险性器械,至少需要HLD7,8。由于目前消化道软式内镜还不耐热,因此只能用化学制剂进行HLD或采用低温灭菌技术。7不幸的是,目前没有任何解决方案被证明可以消除与十二指肠镜有关的微生物污染风险。例如,没有一种低温灭菌技术能使消化道内镜(如十二指肠镜)的无菌保证水平(SAL)达到10-6。其次,与内镜污染相关的医疗事故比任何其他可重复使用的医疗器械都要多7,9。但直到最近才追溯到这些感染是因为处理流程的问题,如清洗不彻底和消毒不当(例如,没有对所有管道进行灌注),内镜损坏或内镜设计问题(如十二指肠镜抬钳器管道),以及自动内镜再处理机(AER)。再处理失败导致多位患者收到通知和进行血源性病原体检测。10第三,专业组织制定了循证内镜再处理指南,CDC以及过去的数据表明,严格遵守这些指南可得到没有病原体的内镜。7,8不幸的是,进一步的数据表明,手工内镜再处理时严格执行所有步骤的概率很小,一些必要的步骤(如刷洗所有内镜管道和部件)甚至常常不做。11由于AER能使大多数步骤自动化,AER能够改进了内镜再处理。7第四,由于对门诊检查的监测不足、定植和感染之间的时间间隔较长以及感染频率较低,与胃肠内镜相关的地方性感染传播可能无法发现。此外,某些手术的风险可能低于其他手术(如结肠镜与ERCP,后者通常无菌区域受到污染)。在Wendorf等人报告的感染事件中,出现了一种不寻常的病原体(产AmpC的大肠杆菌),调查后发现十二指肠镜是暴发的源头。3
国际医疗器械展览会Medtec China 2022同期会议“第六届医疗器械设计论坛”特邀业内权威嘉宾,与医疗器械制造商和设计公司一同分享最前沿的产品设计理念与方式。议题包含内镜/机器人/家用康复医疗设备的研发设计要点,医疗器械研发流程介绍、研发中的设计思维:衔接用户洞察和产品创新、高端仪器装备的研发中需要怎样的设计等,点击快速预登记。
重要的是,与内镜再处理相关的安全边际极小甚至不存在。消化道内镜有严重微生物污染。研究表明,消化道内镜(包括十二指肠镜)的管道内可能含有107-10(7-10 log10)的肠道微生物12,13。调查表明,内镜再处理中的清洗步骤可减少2-6 log10的微生物,而HLD步骤可进一步减少4-6 log10的分枝杆菌,总共可减少6-12 log10的微生物。12-14因此,与消化道内镜清洗和HLD相关的安全系数最小或不存在(污染水平:4 log10 [最大污染,最差清洗/HLD]到-5 log10 [最小污染,最大清洗/HLD])。因此,再处理过程的任何偏差(如抬钳器管道相关缝隙)都可能导致无法消除污染,并有可能随后在病人之间传播。手术器械清洗消毒相关的安全系数为17 log10,与此相比,内镜再处理相关的安全系数很低(或不存在)。
我们现在能做什么?遗憾的是,目前还没有一种简单又行之有效的技术或预防策略可供医院用来保证患者安全。当然,我们必须继续强调采用循证实践,包括设备维护和常规审查,加上至少每年对再处理人员进行一次能力测试。7,8所有再处理人员必须了解十二指肠镜的再处理说明并接受全面培训。这种培训包括用新的小毛清洗刷以及对抬钳器管道进行额外的冲洗和清洗步骤等新建议15。尽管这些步骤“经过验证”,但没有关于这些清洗建议能否得到无细菌的ERCP内镜的数据。我们必须做更多工作,否则还会继续爆发其他感染。我们必须获得更多关于严格遵守现行指南清洗和高水平消毒过的内镜的微生物污染频率和水平的信息。如果发现内镜被潜在的病原体(例如肠道革兰氏阴性杆菌)污染,则需要量化这种污染的临床影响。此外,根据Wendorf等人和其他人的研究3-5,考虑定期对十二指肠镜进行微生物监测评估微生物污染,作为预防策略的一个组成部分是合理的。然而,培养结果要延迟2-3天,与微生物监测有关的许多问题仍然存在。应该用什么界限来定义正确消毒(例如,每管道的肠道病原体为0还是更高数量[如< 10 CFU])?是否应该有一个针对相对非病毒性病原体(如凝固酶阴性葡萄球菌)的单独分界线?应该使用什么抽样方案来评估消化道内镜(如所有内镜还是内镜的一个样本)?如果一家医院对10条内镜中的2条进行培养,其中1条内镜呈阳性,他们是否需要对所有10条内镜进行再处理,因为抽样的内镜有50%阳性?如果医院定期进行微生物培养,发现20%的抽样内镜呈阳性,内镜科室应该采取什么措施(如通知病人并提供血源性病原体检测,粪便CRE检查,对阳性内镜进行环氧乙烷[ETO]灭菌,和/或对所有十二指肠镜进行HLD然后进行ETO灭菌)?工作人员是否接受过对十二指肠镜管道以及抬钳器管道进行培养的培训?最后,进一步行动的触发点是基于污染的程度还是污染的频率(即被污染的内镜的百分比)?6此外,如果医院决定对所有内镜进行培养,并在等待培养结果时将内镜隔离48-72小时后再使用,必须认识到内镜抬钳器管道或内镜进行培养的敏感性是未知的(即必须有多少微生物污染内镜才能产生一个阳性培养?)。 国际医疗器械展览会Medtec China 2022包装和消毒参展企业包括贝里精英包装、安姆科中国、卡尔托利、科佩、奥力拓、香港奥星集团等,他们将在现场带来包括环氧乙烷尾气处理设备、医疗厂房洁净室系统、洁净室规划&设计&施工&管理、灭菌指示剂、Simco 6115型离子风枪、植入材料清洗剂、环氧乙烷灭菌服务、PTFE喷涂、辐照灭菌服务等。
开发和验证评估清洗和HLD的有效性以及感染风险的实时监测方法是有必要的。检测流体的三磷酸腺苷(ATP)已被提议作为评估清洁度的监测工具16,17,因为它可以检测有机残留物。内镜制造商需要重新设计他们的内镜(例如,抬钳器管道),使其更容易实现HLD或灭菌。
我们预测,如果只采用上述的强化策略,我们还会继续看到与ERCP内镜和消化道内镜有关的爆发事件。
这种感染预防挑战的一个根本解决方案是开发新的内镜再处理技术,通过FDA批准的灭菌过程对十二指肠镜和其他消化道内镜进行可靠的灭菌,使其达到10-6的无菌保证水平(SAL)。应该评估的一些灭菌技术包括臭氧加过氧化氢蒸汽、二氧化氮18、超临界二氧化碳、过乙酸蒸汽、气态二氧化氯、过氧化氢气体等离子体,以及用于耐热内镜的压力蒸汽灭菌。这些新技术可以极大地提高安全系数并消除病人的风险。Epstein等人4使用ETO终止了感染暴发,但ETO对一些医院来说可能只能暂时解决问题,从长远来看却并不是一个令人满意的解决方案。许多医院不再使用ETO,因为灭菌/通风时间很长(如12-15小时),而且该过程最终可能会损坏内镜。。此外,在同行评议的文献中,没有研究表明我们可以仅仅依靠再处理说明的清洗(即刷洗和冲洗)加上ETO(或其他低温灭菌技术)就能给十二指肠镜灭菌。事实上,Alfa等人19发现,用血清和盐负荷与管腔载体一起作为测试挑战时,用100%ETO或过氧化氢气体等离子体的灭菌效力分别只有39.7%和35%。在有盐和血清的情况下,用7种生物接种中空圆筒,100%ETO和过氧化氢气体等离子体的灭菌效力分别为60.3%和37%。19,20因此,如果医院考虑通过ETO强化ERCP再处理,在ETO之前应按照再处理说明对每条内镜进行清洗和高水平消毒并干燥。事先的清洗和HLD可以减少可能干扰ETO灭菌效果的微生物负荷和有机物。根据现有数据,在有盐和血清的情况下,ETO(或其他低温灭菌技术)不太可能杀灭管腔器械中的大量病原体。
表1列出了各种强化HLD或灭菌措施的优缺点,表2提供了当前和未来的替代方案。但其中许多策略可能会增加资本设备和再处理成本,导致工作流程和处理改变,并可能导致ERCP手术中使用的十二指肠镜暂时缺失。考虑到这些和其他原因(包括医疗-法律),我们建议感染预防临床医生为十二指肠镜再处理的改进寻求行政级别的支持,以尽量减少感染风险。另外,开发一次性无菌消化道内镜或转向其他无菌诊断方式(如胶囊内镜、检测消化道癌症的血液检查等)将避免与内镜HLD有关的爆发。
表1.十二指肠镜高水平消毒(HLD)和灭菌强化的优缺点概述
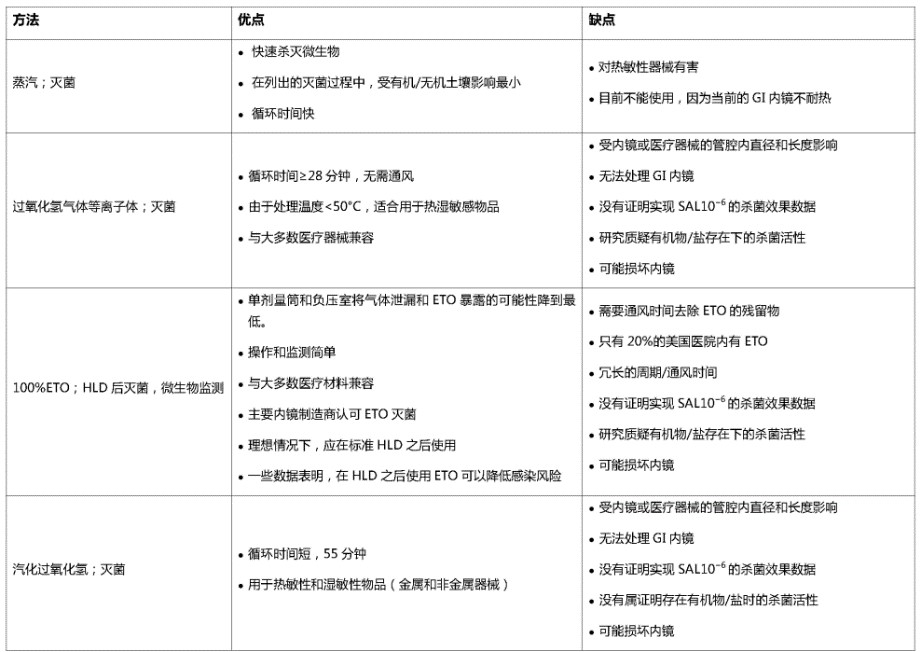
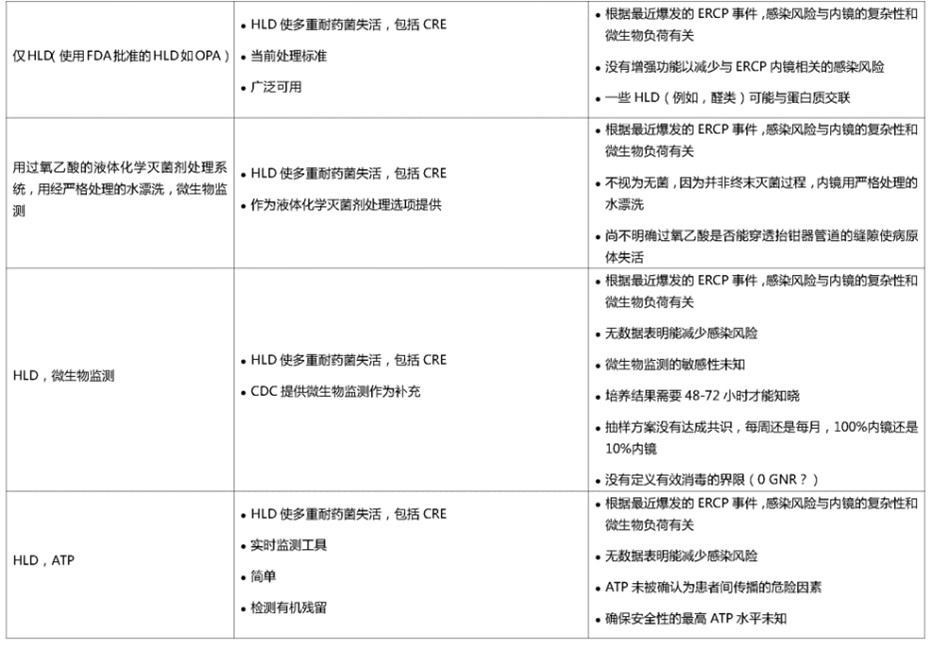
表2.胃肠道(GI)内镜高水平消毒(HLD)的挑战和保证安全的预防方法

必须紧急采取改进的预防策略。尽管ERCP后MDR感染的风险非常低,但必须消除任何可避免的感染风险。内镜、AER、高水平消毒剂和低温灭菌技术的制造商和联邦当局(如CDC、FDA、国立卫生研究院)必须参与进来,提供足够的资源来设计和完成必要的研究,确定目前内镜再处理所带来的风险和开发新的再处理方法。应鼓励感染预防临床医生报告和公布与内镜有关的更多爆发,特别是在遵循目前的再处理方法的情况下,这样我们就可以确定最近的报告是代表着大问题还是只是异常事件。因此,与ERCP和GI内镜相关的感染预防是多方面的,没有任何单独一种立竿见影的策略可以消除这个问题。然而,眼前的风险可以通过一个多组合的策略(例如,遵守内镜再处理指南,HLD后再进行ETO,以及定期微生物采样)来最小化。只有当我们采用新的技术,如内镜重新设计、一次性无菌镜和使用SAL为10-6的GI内镜灭菌技术,才能消除十二指肠镜和其他GI内镜的感染风险。
来源:鲁沃夫CSSD国际论坛











