质量管理
-
2024.10.12
国际医疗器械展览会Medtec详解洁净区的压差控制
阅读更多 -
2024.09.12
上海医疗器械博览会Medtec浅谈医疗器械动物试验设计考虑要点
本文系统性总结了动物试验设计在医疗器械研发中的考虑要点,参考了多份权威文件。内容涵盖动物试验与设计开发的关系、样品要求、对照品选择、样本量设计、方案及报告要求等方面。强调了动物试验在确认医疗器械可行性、安全性和有效性中的作用,并详细说明了可行性研究和安全/有效性研究在设计开发流程中的不同应用。
阅读更多 -
2024.09.11
医疗器械行业展览Medtec干货 | 关于医疗器械实验动物的选择和依据
本文讨论了医疗器械动物试验的重要性、必要性、实验动物的选择以及实验方案设计的复杂性。指出动物试验是确认医疗器械风险控制措施有效性的关键手段,并强调随着监管规范化,越来越多二类医疗器械在注册时也需补充动物实验。
阅读更多 -
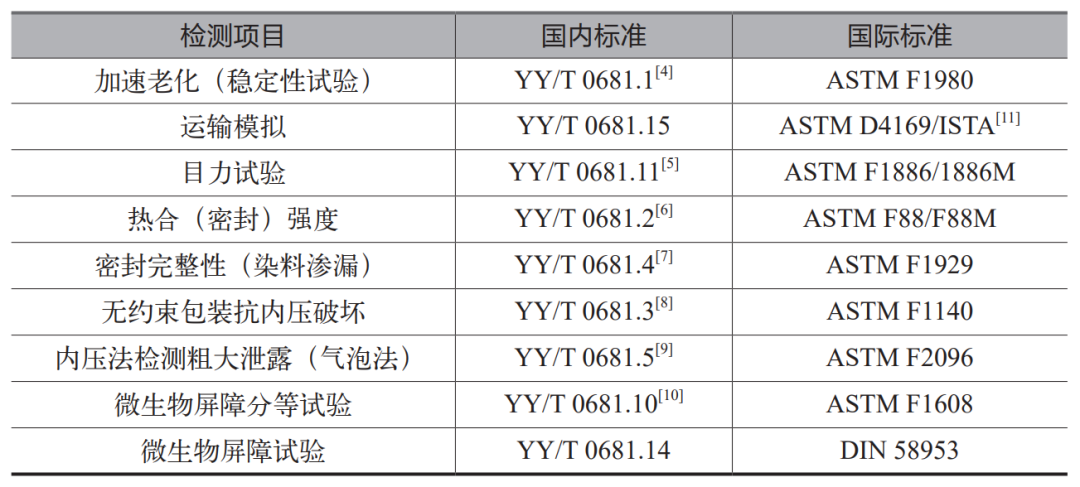
2024上海医疗设备展Medtec详解 无菌医疗器械包装质量控制要点(上)
本文全面探讨了无菌医疗器械包装的重要性、材料分类、国内外标准以及质量控制流程。无菌包装作为医疗器械的最后一道防护,需具备阻隔微生物、维持无菌状态及耐受多种灭菌方式的能力。材料上分为纸、聚烯烃非织造布、塑料膜、玻璃等,包装形式则多样。
阅读更多 -
2024.09.03
2024医疗器械展会Medtec简述医械生物相容性评价的目标和方法
医疗器械生物相容性评价是确保其临床安全有效的关键,需贯穿产品全生命周期,综合考虑材料、工艺、降解产物等因素,方法需不断更新。
阅读更多 -
2024.09.01
上海医疗器械博览会Medtec解析 仪器校准中正确度、精确度、精密度有什么区别?分别是什么定义?
计量中的正确度指测量值与真值的差距,精确度反映测量值与标准值的差距,精密度则体现多组测量数据之间的数值误差。三者各有定义。
阅读更多 -
2024.08.31
医疗器械行业展览Medtec视角 | 医疗器械生物相容性简介、流程、路径和数据
医疗器械生物相容性评价是确保产品安全性和有效性的重要环节,涉及全面评估生物学反应和风险,需遵循相关标准和法规进行评价。
阅读更多 -
2024.08.29
上海医疗器械展会Medtec谈医疗器械原材料变更的基本流程
本文讨论了医疗器械原材料变更的重要性及其基本流程,包括识别变更形式、变更研究内容、风险分析、通知第三方、上市后监测等,强调变更需受控并按流程评估。
阅读更多 -
国际医疗器械展览会Medtec谈MDR和FDA的器械可用性测试
本文中国际医疗器械展览会Medtec讨论了医疗器械可用性验证的重要性,指出测试应涵盖所有操作设备的人员,并详细介绍了可用性工程报告的要求。

阅读更多 -
2024.08.27
2024医疗器械展览会Medtec解析医疗器械生产组织的质量管理体系需满足的四方面要求
医疗器械生产组织的质量管理体系需满足四大要求:一是遵循GB/T42061标准,涵盖从设计到生产各阶段的质量管理;二是遵守国家和地方法规,确保产品安全合规;三是满足顾客对性能、质量、交付和服务的期望;四是符合组织自身发展目标,提升效率和竞争力。2024医疗器械展览会Medtec将聚焦市场趋势,提供交流平台,助力企业优化质量管理体系。
阅读更多














